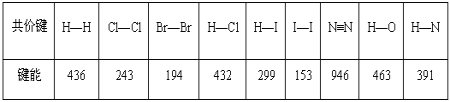
题目内容
【题目】下列事实不能用勒夏特列原理解释的是
A.打开汽水瓶时,有大量气泡溢出
B.在配制硫酸亚铁溶液时往往要加入一定量铁粉
C.氨水应密闭保存放置于低温处
D.实验室用排饱和食盐水的方法收集氯气
【答案】B
【解析】
A.打开汽水瓶时,压强减小,气体的溶解平衡逆向移动,气体逸出,能用勒夏特列原理解释,A不选;
B.在配制硫酸亚铁溶液时往往要加入一定量铁粉,防止亚铁离子被氧化,与平衡无关,不能用勒夏特列原理解释,B选;
C.氨气溶于水存在溶解平衡,温度低有利于氨气的溶解,与平衡有关,能用勒夏特列原理解释,C不选
D.氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应:Cl2+H2O![]() HClO+H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于增大了生成物氯离子浓度,根据勒夏特列原理,平衡向逆反应方向移动,氯气的溶解量减小,可用勒夏特列原理解释,D不选;
HClO+H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于增大了生成物氯离子浓度,根据勒夏特列原理,平衡向逆反应方向移动,氯气的溶解量减小,可用勒夏特列原理解释,D不选;
答案选B。
【点晴】
掌握勒夏特列原理的含义和适用范围是解答的关键,勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动。使用勒夏特列原理时,该过程必须是可逆过程,否则勒夏特列原理不适用,溶解平衡、化学平衡、电离平衡和水解平衡均适用于勒夏特列原理。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】在一定条件下,将A和B各0.32 mol充入10 L的恒容密闭容器中,发生如下反应:A(s)+B(g)![]() 2C(g) △H<0,反应过程中测定的数据如表,则下列说法正确的是
2C(g) △H<0,反应过程中测定的数据如表,则下列说法正确的是
t/min | 0 | 2 | 4 | 7 | 9 |
n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A.反应前2 min的平均反应速率v(C)=0.004 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前,v(逆)>v(正)
C.其他条件不变,起始时向容器中充入各0.64 mol的A和B,平衡时n(C)<0.48 mol
D.其他条件不变,向平衡体系中再充入0.32 mol B和0.16 mol C,再达到平衡时,A的转化率增大