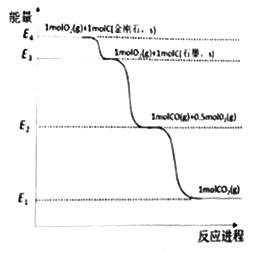
题目内容
【题目】液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,
KOH作为电解质。下列关于该燃料电池的叙述不正确的是
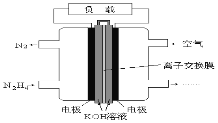
A.电流从右侧电极经过负载后流向左侧电极
B.负极发生的电极反应式为:N2H4+4OH--4e - =N2+4H2O
C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D.该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜
【答案】D
【解析】
试题分析:A.该燃料电池是以肼为燃料,在反应中肼失去电子,作电池的负极,右边进入空气,得到电子,作为电池的正极,电池中,电流总是从电池的正极流向电池的负极,A项正确;B.负极发生的电极反应式为:N2H4+4OH--4e-=N2+4H2O,B项正确;C.因为该电池的两极用的是气体反应物,该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触,C项正确;D.该燃料电池持续放电时,在电池的负极消耗掉氢氧根离子,而在电池的正极生成氢氧根离子,在正极生成的氢氧根离子应该从右向左移动,以保证负极有足够多的氢氧根离子参与反应,因而离子交换膜需选用阴离子交换膜,D项错误;答案选D。

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目