题目内容
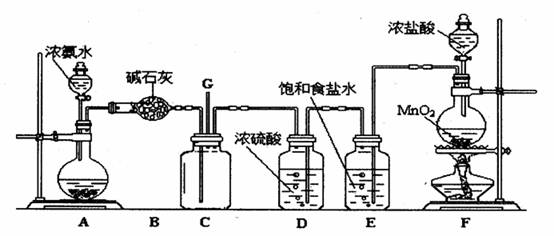
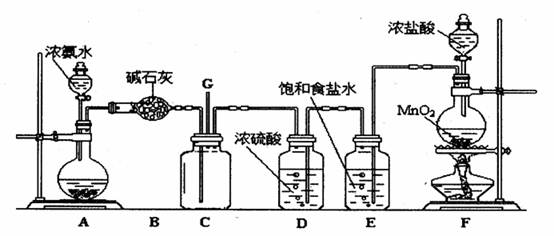
(10分)某学生利用以下装置探究氯气与氨之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨反应的装置。
请回答下列问题:
(1)装置F中发生反应的化学方程式为 .
(2)装置B中仪器的名称是 ;装置E的作用是 .
(3)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。
写出反应的化学方程式 .
(4)装置C内当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗数
常数为 mol-1 (用含a、b的代数式表示)。
(5)将用F、E、D装置制得的氯气通人含74gCa(OH)2的石灰乳中,最多可制得漂白粉 g.
解析:略

(12分).市场销售的某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装日期 |
|
分装企业 |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空
白处):____![]()
(2)上述反应生成的![]() 可用四氯化碳检验:确认有
可用四氯化碳检验:确认有![]() 生成的现象是___________________
生成的现象是___________________
利用![]() 。稀溶液,将
。稀溶液,将![]() 还原,可从碘的四氯化碳溶液中回收四氧化碳。
还原,可从碘的四氯化碳溶液中回收四氧化碳。![]() 稀溶液与
稀溶液与![]() 反应的离子方程式为____________________________
反应的离子方程式为____________________________
(3)已知:![]() 某学生测定食用精制盐的碘含量,其步骤为:
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解:
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO![]() 与KI反应完全;
与KI反应完全;
c.以淀粉溶液为指示剂。逐滴加入物质的量浓度为2.0×10![]() mol/L的
mol/L的![]() 溶液10.OmL,恰好反应完全。
溶液10.OmL,恰好反应完全。
①判断c中恰好完全反应依据的现象是_____________________________________。
②b中反应所产生的![]() 的物质的量是____________mol。
的物质的量是____________mol。
③根据以上实验和包装袋说明测得精制盐的碘(I)含量是(以含w的代数式表示)
___mg/kg。