题目内容
17.生物法净化含硫废气时发生如下反应:CH3COOH+SO${\;}_{4}^{2-}$$\frac{\underline{\;脱硫弧菌\;}}{\;}$2HCO${\;}_{3}^{-}$+H2S,下列有关说法正确的是( )| A. | CH3COOH分子中所有原子可能共平面 | |
| B. | 该反应能够发生是因为CH3COOH酸性比H2S酸性强 | |
| C. | H2S分子既存在极性键又存在非极性键 | |
| D. | 该反应每消耗4.8gSO42-,转移0.4NA个电子(NA为阿伏加德罗常数) |
分析 A、CH3COOH相当于是甲烷中的1个H被羧基取代生成的产物,甲烷中4个H与C原子构成正四面体结构,故甲酸也是四面体结构;
B、此反应为氧化还原反应,不是强酸制取弱酸;
C、不同种原子之间形成的共价键为极性共价键;
D、依据n=$\frac{m}{M}$计算出硫酸根的物质的量,依据氧化还原反应得失电子判断即可.
解答 解:A、CH3COOH相当于是甲烷中的1个H被羧基取代生成的产物,甲烷中4个H与C原子构成正四面体结构,故甲酸也是四面体结构,故乙酸中所有原子不可能共平面,故A错误;
B、该反应能够发生是因为CH3COOH与硫酸根在脱硫弧菌的条件下发生氧化还原反应,不是强酸制取弱酸,故B错误;
C、硫化氢的结构为H-S-H,为极性共价键,不存在非极性共价键,故C错误;
D、4.8g硫酸根的物质的量为:$\frac{4.8g}{96g/mol}$=0.05mol,每消耗1mol的硫酸根,转移电子数为:+6-(-2)=8mol,故消耗4.8g硫酸根转移电子数为:0.05mol×8=0.4mol,故D正确,
故选D.
点评 本题综合性较强,有一定难度,涉及考查了甲烷的结构知识的认识与迁移、氧化还原反应原理、共价键类型的判断等,注意总结.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
7.下列有关物质水解的说法正确的是( )
| A. | 蛋白质水解的最终产物是多肽 | B. | 淀粉水解的最终产物是葡萄糖 | ||
| C. | 卤代烃在酸性环境水解生成醇 | D. | 油脂的水解反应又称为皂化反应 |
5.几种短周期元素的原子半径及主要化合价如下表:下列叙述不正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5+3-3 | -2 |
| A. | X、Y元素的金属性X>Y | |
| B. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,Z单质与W的常见单质直接生成ZW |
12.下列溶液中各微粒的浓度关系正确的是( )
| A. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+) | |
| B. | 将10mL0.1mol•L-1Na2CO3溶液逐滴滴加到10mL0.1mol•L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) | |
| C. | 向NH4HCO3溶液中滴加NaOH溶液至pH=7:c(NH4+)+c(Na+)=c(HCO3-)+c(CO32-) | |
| D. | 0.2mol•L-1的某一元弱酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)=2c(H+)+c(HA) |
2.工业上可用亚氢酸钠和盐酸为原料制备ClO2,反应如下:
5NaClO2+4HCl(稀)═5NaCl+4ClO2↑+2H2O(主反应)
NaClO2+4HCl(浓)═NaCl+2Cl2↑+2H2O(副反应)
下列说法正确的是( )
5NaClO2+4HCl(稀)═5NaCl+4ClO2↑+2H2O(主反应)
NaClO2+4HCl(浓)═NaCl+2Cl2↑+2H2O(副反应)
下列说法正确的是( )
| A. | 主反应和副反应的还原剂都是HCl | |
| B. | 副反应中氧化剂和还原剂物质的量之比为1:4 | |
| C. | 盐酸的还原性与浓度有关,浓度越大还原性越强 | |
| D. | 为加快ClO2的生成速率,应选用较大浓度的盐酸 |
9.下列关于甲、乙、丙、丁四个图象的说法中,不正确的是( )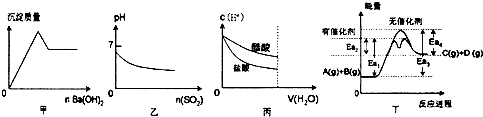

| A. | 甲是向KAl(S04)2溶液滴加Ba(OH)2时,沉淀质量与Ba(OH)2物质的量的关系图 | |
| B. | 乙是向溴水通入SO2气体时,pH与SO2物质的量的关系图 | |
| C. | 丙是向c(H+)相同的醋酸和盐酸滴入水时,c(H+)与水体积的关系图 | |
| D. | 由丁可知,A与B在有催化剂存在的热化学方程式为:A(g)+B(g)?C(g)+D(g)△H=+(Ea3-Ea4)kJ/mol |
6.用高铁酸钠(Na2FeO4)对江湖水消毒是城市饮水处理的新技术.已知获得高铁酸钠的反应为Fe2O3+mNa2O2═nNa2FeO4+Na2O,下列说法中正确的是( )
| A. | 该反应中,铁元素的化合价由+3价升高到+6价 | |
| B. | 该反应涉及的物质都是氧化物 | |
| C. | 化学计量数m=n | |
| D. | 反应前后原子发生了改变 |
7.在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在氢氧化钠溶液和硫酸铜溶液中片刻(如图所示),则下列说法正确的是( )
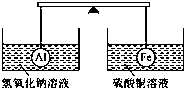

| A. | 两烧杯中均无气泡产生 | B. | 左边烧杯中的溶液质量减少了 | ||
| C. | 去掉两烧杯,杠杆仍平衡 | D. | 右边铁球上出现红色 |