题目内容
6.用高铁酸钠(Na2FeO4)对江湖水消毒是城市饮水处理的新技术.已知获得高铁酸钠的反应为Fe2O3+mNa2O2═nNa2FeO4+Na2O,下列说法中正确的是( )| A. | 该反应中,铁元素的化合价由+3价升高到+6价 | |
| B. | 该反应涉及的物质都是氧化物 | |
| C. | 化学计量数m=n | |
| D. | 反应前后原子发生了改变 |
分析 A、化合物中元素化合价的代数和为零计算出Fe2O3中铁元素的化合价为+3价,生成物Na2FeO4中铁元素的化合价为+6价;
B、根据氧化物是由两种元素组成,其中一种元素为氧元素来判断;
C、根据质量守恒定律,反应前有2个铁原子,故n=2,则反应后钠的原子个数为6个,故m=3;
D、根据原子是化学变化中最小的粒子解答;
解答 解:A、该反应中,反应物Fe2O3中铁元素的化合价为+3价,生成物Na2FeO4中铁元素的化合价为+6价,故A正确;
B、氧化物是由两种元素组成,其中一种元素为氧元素,而方程式中Na2FeO4的组成元素有三种,故B错误;
C、根据质量守恒定律,反应前有2个铁原子,故n=2,则反应后钠的原子个数为6个,故m=3,故C错误;
D、原子在化学变化前后不会发生改变,故D错误;
故选A.
点评 本题考查化合价原则、氧化物定义以及质量守恒定律的内容,考查注重基础.

练习册系列答案
相关题目
15. 某离子晶体中晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体化学式可能为( )
某离子晶体中晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体化学式可能为( )
 某离子晶体中晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体化学式可能为( )
某离子晶体中晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体化学式可能为( )| A. | CaF2 | B. | CaO2 | C. | CaC2 | D. | Na2O2 |
17.生物法净化含硫废气时发生如下反应:CH3COOH+SO${\;}_{4}^{2-}$$\frac{\underline{\;脱硫弧菌\;}}{\;}$2HCO${\;}_{3}^{-}$+H2S,下列有关说法正确的是( )
| A. | CH3COOH分子中所有原子可能共平面 | |
| B. | 该反应能够发生是因为CH3COOH酸性比H2S酸性强 | |
| C. | H2S分子既存在极性键又存在非极性键 | |
| D. | 该反应每消耗4.8gSO42-,转移0.4NA个电子(NA为阿伏加德罗常数) |
14.除去混在HNO3中的少量盐酸,可加适量的( )
| A. | NaOH | B. | BaCl2 | C. | Zn | D. | AgNO3 |
1.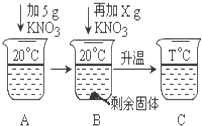 下表是KNO3、NaCl在不同温度下的部分溶解度数据,请回答问题:
下表是KNO3、NaCl在不同温度下的部分溶解度数据,请回答问题:
(1)40℃时,将70gKNO3固体加入100g水中,充分搅拌,形成的溶液质量为163.9g.
(2)60℃时,KNO3的饱和溶液中含有少量NaCl,可通过降温结晶方法获得较纯净的KNO3晶体.
(3)t℃时,NaCl和KNO3的饱和溶液溶质质量分数相同,该温度范围是B.
A.10℃~20℃B.20℃~40℃C.40℃~60℃D.60℃~80℃
(4)向20mL水中溶解一定量KNO3固体的操作如下图:请根据实验现象和溶解度数据回答:A、B、C中溶液一定不饱和溶液的是A.当x=1.32g时,B中恰好没有固体剩余.
 下表是KNO3、NaCl在不同温度下的部分溶解度数据,请回答问题:
下表是KNO3、NaCl在不同温度下的部分溶解度数据,请回答问题:| 温度(℃) | 10 | 20 | 40 | 60 | 80 |
| KNO3 | 20.9 | 31.6 | 63.9 | 110 | 169 |
| NaCl | 35.8 | 36 | 36.6 | 37.3 | 38.4 |
(2)60℃时,KNO3的饱和溶液中含有少量NaCl,可通过降温结晶方法获得较纯净的KNO3晶体.
(3)t℃时,NaCl和KNO3的饱和溶液溶质质量分数相同,该温度范围是B.
A.10℃~20℃B.20℃~40℃C.40℃~60℃D.60℃~80℃
(4)向20mL水中溶解一定量KNO3固体的操作如下图:请根据实验现象和溶解度数据回答:A、B、C中溶液一定不饱和溶液的是A.当x=1.32g时,B中恰好没有固体剩余.
18.下列有关化学用语或叙述正确的是( )
| A. | C30、N70、C120、C340等互称为同素异形体 | |
| B. | CH3CH2CH2CH2OH的名称是:丁醇 | |
| C. | 2-戊烯的结构简式:CH3CH2CH=CHCH3 | |
| D. | 质子数为94、中子数为144的钚(Pu)原子:${\;}_{92}^{144}$Pu |
15.下列说法正确的是( )
| A. | 乳酸薄荷醇酯(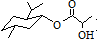 )只能发生水解、氧化、消去反应 )只能发生水解、氧化、消去反应 | |
| B. | 乙醛和丙烯醛不是同系物,它们的氢化产物也一定不是同系物 | |
| C. | 分子式为C7H14O2的有机物中,含3个甲基且能发生银镜反应还能发生水解反应的同分异构体数目是8个 | |
| D. | 硝化甘油、硝化纤维、硬脂酸甘油酯两两互不为同分异构体,其水解产物也完全不相同 |
16.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | ${\;}_{17}^{35}$Cl2与${\;}_{17}^{37}$Cl2氧化能力相近,二者互为同位素 | |
| B. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se所含质子数相同,中子数不同 | |
| C. | 同主族元素形成的含氧酸的酸性随核电荷数的增加而减弱 | |
| D. | 同周期主族元素形成的简单离子半径随核电荷数的增大而减小 |