题目内容
11.5.4g水与29.4g硫酸所含的分子数相等,它们所含氧原子数之比是_1:4,其中氢原子数之比是_1:1.若将上述硫酸配成500mL溶液,所得溶液的溶质的物质的量浓度为_0.6mol•L-1.分析 根据n=$\frac{m}{M}$计算5.4g水的物质的量,硫酸与水所含分子数目相等,则二者物质的量相等,根据m=nM计算硫酸的质量,所含氧原子数之比等于分子中含有氧原子数目之比,氢原子数之比等于分子中含有氢原子数目之比,根据c=$\frac{n}{V}$计算所得溶液物质的量浓度.
解答 解:5.4g水的物质的量=$\frac{5.4g}{18g/mol}$=0.3mol,硫酸与水所含分子数目相等,则二者物质的量相等,故硫酸的质量=0.3mol×98g/mol=29.4g,所含氧原子数之比等于分子中含有氧原子数目之比,故所含氧原子数之比=1:4,氢原子数之比1:1,将上述硫酸配成500mL溶液,所得溶液的溶质的物质的量浓度为$\frac{0.3mol}{0.5L}$=0.6mol/L,
故答案为:29.4;1:4;1:1;0.6mol•L-1.
点评 本题考查物质的量有关计算,比较基础,侧重对基础知识的巩固,注意对公式的理解.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
1.下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 硅酸胶体:OH-、K+、S2-、Na+ | B. | 空气:C2H4、CO、SO2、NO | ||
| C. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | D. | 高锰酸钾溶液:H+、Na+、SO42-、Fe2+ |
2.甲烷分子中4个氢原子被苯基取代,可得如图所示分子,对该分子的描述正确的是( )
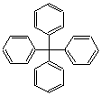

| A. | 此物质属于芳香烃 | B. | 所有碳原子可能在同一平面上 | ||
| C. | 此分子的一氯取代产物有12种 | D. | 此物质分子式为C25H20 |
19.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 1 mol甲基(-CH3)所含的电子总数为9 NA | |
| B. | 标准状况下,22.4L氯仿所含的共价键为4NA | |
| C. | 常温常压下,142g C10H22中含共价键的数目为31NA | |
| D. | 标准状况下,22.4L甲烷所含的极性共价键数目为4NA |
3.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+? | |
| B. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| C. | pH=12的溶液:K+、Ba2+、Cl-、Br- | |
| D. | 碳酸氢钠溶液:K+、SO32-、Cl-、H+ |
1.标准状况下V L氨气溶解在1L水中(水的密度近似为1g/mL),所得氨水溶液的密度为ρ g/mL,质量分数为w,物质的量浓度为cmol/L,则下列关系式中不正确的是( )
| A. | w=$\frac{17c}{(1000ρ)}$ | B. | ρ=$\frac{(17V+22400)}{(22.4+22.4V)}$ | ||
| C. | c=$\frac{1000ρV}{(17V+22400)}$ | D. | w=$\frac{17V}{(17V+22400)}$ |