题目内容
【题目】如图为25℃时,向25mL0.1mol·L-1NaOH溶液中逐滴滴加0.2mol·L-1CH3COOH溶液过程中混合溶液pH的变化曲线。
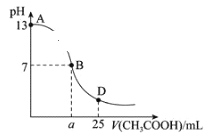
(1)NaOH与CH3COOH恰好完全反应时溶液中各离子浓度大小关系为__。
(2)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是__(填序号)。
A.c(OH-)一定大于c(CH3COO-) B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-) D.c(OH-)大于、小于或等于c(CH3COO-)
(3)在B点时,溶液中各离子浓度大小关系为__。
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH)__2c(Na+)(填“>”“<”或“=”)。D点混合溶液的质子守恒的关系为__。
【答案】c(Na+)>c(CH3COO-)>c(OH-)>c(H+) D c(Na+)=c(CH3COO-)>c(H+)=c(OH-) = c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
【解析】
以滴定实验为背景,结合滴定曲线进行分析,后面的小题又对离子浓度大小进行比较,最后涉及了离子积常数的计算以及pH值的计算。
(1)醋酸钠水解使溶液显碱性,NaOH与CH3COOH恰好完全反应时,离子浓度大小关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(2)A.在AB段溶液显示碱性,在接近B点时,溶液中醋酸根离子浓度远远大于氢氧根离子浓度,选项A错误;
B.在接近A时,即加入的醋酸少量,则混合液中氢氧根离子浓度大于醋酸根离子,选项B错误;
C.在AB段,根据选项A、B的分析可知,混合液中氢氧根离子浓度与醋酸根离子不一定相等,选项C错误;
D.根据以上分析可知,溶液中c(OH-)可能大于、等于或小于c(CH3COO-),选项D正确;
答案选D;
(3)在B点时,溶液呈中性c(H+)=c(OH-),根据电荷守恒c(Na+)+ c(H+)=c(CH3COO-)+c(OH-),则c(Na+)=c(CH3COO-),溶液中醋酸根离子浓度远远大于氢氧根离子浓度,各离子浓度大小关系为c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(4)在D点时,反应后醋酸剩余,溶液的组成为等浓度的醋酸和醋酸钠的混合物,根据物料守恒,此时:c(CH3COO-)+c(CH3COOH)=2c(Na+);D点的电荷守恒为c(Na+)+ c(H+)=c(CH3COO-)+c(OH-),将电荷守恒乘以2,由物料守恒代入消去c(Na+),则D点混合溶液的质子守恒的关系为c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)。