题目内容
【题目】如图所示表示一些元素原子半径规律性的变化示意图。由此图不能得出下列结论的是(不考虑稀有气体元素)

A.当电子层数相同时,核电荷数越小,原子半径越大
B.当最外层电子数相同时,质子数越多,原子半径越大
C.r(F-)<r(Cl-)<r(Br-)<r(I-),r(K+)>r(Na+)>r(Mg2+)>r(Al3+)
D.原子电子层数越多,对应的原子半径越大
【答案】D
【解析】
A.当电子层数相同时,核电荷数越小,核对外层电子的吸引力越小,原子半径越大,故A能由此图得出结论;
B.当最外层电子数相同,处于同一主族,质子数越大,电子层数越多,原子半径就越大,故B能由此图得出结论;
C.对于F-、Cl-、Br-、I-,电子层数依次增加,离子半径依次增大,r(F-)<r(Cl-)<r(Br-)<r(I-)。对于K+与Na+、Mg2+、Al3+来说,K+比它们多1个电子层,故半径大于Na+、Mg2+、Al3+,而对于Na+、Mg2+、Al3+来说,最外层电子数相同,而核电荷数依次增加,原子核对核外电子的吸引能力增强,故半径大小为r(K+)>r(Na+)>r(Mg2+)>r(Al3+) ,故C能由此图得出结论;
D.同主族原子,原子电子层数越多,对应的原子半径越大,如果不是同主族,例如Li和S,电子层数大的S原子,半径反而小,故D不能由此图得出结论;
答案选D。

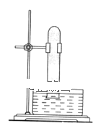
【题目】下列实验结论与实验操作及现象不相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某酸雨样品中加入Ba(OH)2溶液,有白色沉淀生成 | 酸雨试样中一定含SO42- |
B | 向KI-淀粉溶液中滴入氯水,溶液变成蓝色 | I-的还原性强于Cl- |
C | 将Ba(OH)2·8H2O和NH4Cl晶体在小烧杯中混合搅拌,用手触摸烧杯外壁感觉变凉 | Ba(OH)2·8H2O与NH4Cl的反应是吸热反应 |
D | 向某盐溶液中加入NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口,试纸变蓝 | 该盐溶液中含有NH4+ |
A.AB.BC.CD.D