题目内容
我国高校目前联合研究一种稀土制冷材料,其主要成分是LaCaMnO。
(1)锰原子的基态价层电子排布式为______
(2)S与O为同主族元素,其中电负性较大的是____________;H2S分子中S原子杂化轨道类型为______;试从结构角度解释H2SO4的酸性大于H2SO3的酸性:_______。
(3)据报道,Ca在空气中点燃生成CaO和少量Ca2N2。
①Ca2N2和水反应生成NH2-NH2,NH2—NH2能否作配体?______(填“能”或“否”)
②CaO形成的晶体与NaCl晶体一样,为面心立方最密堆积,则一个CaO晶胞中含 有Ca2+数为______ ;欲比较CaO与NaCl的晶格能大小,需考虑的数据是______。
(1)锰原子的基态价层电子排布式为______
(2)S与O为同主族元素,其中电负性较大的是____________;H2S分子中S原子杂化轨道类型为______;试从结构角度解释H2SO4的酸性大于H2SO3的酸性:_______。
(3)据报道,Ca在空气中点燃生成CaO和少量Ca2N2。
①Ca2N2和水反应生成NH2-NH2,NH2—NH2能否作配体?______(填“能”或“否”)
②CaO形成的晶体与NaCl晶体一样,为面心立方最密堆积,则一个CaO晶胞中含 有Ca2+数为______ ;欲比较CaO与NaCl的晶格能大小,需考虑的数据是______。
(1)3d34s2(2)O sp3 硫酸分子中的非羟基氧原子数比亚硫酸多(3)①能②4钙离子、氧离子与钠离子、氯离子的离子半径与离子电荷数
试题分析:(1)锰是25号元素,3d和4s上的电子是其价电子,根据构造原理知其价电子排布式为:3d34s2,故答案为:3d34s2;(2)同一主族中,元素的电负性随着原子序数的增大而减小,O元素的非金属性比S强,所以O元素的电负性大于S;H2S分子中S原子含有4个价层电子对,所以其杂化轨道类型为sp3,同一元素的不同含氧酸中,非羟基氧原子数越大其酸性越强,硫酸分子中的非羟基氧原子数比亚硫酸多,所以H2SO4的酸性大于H2SO3的酸性;(3)①NH2-NH2中氮原子含有孤电子对,所以能作配体,故答案为:能;②一个CaO晶胞中含有Ca2+数=×
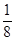 +6×
+6×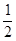 =4,晶格能和离子所带电荷成正比,与离子半径成反比,所以要比较钙离子、氧离子与钠离子、氯离子的离子半径与离子电荷数,故答案为:4;钙离子、氧离子与钠离子、氯离子的离子半径与离子电荷数.
=4,晶格能和离子所带电荷成正比,与离子半径成反比,所以要比较钙离子、氧离子与钠离子、氯离子的离子半径与离子电荷数,故答案为:4;钙离子、氧离子与钠离子、氯离子的离子半径与离子电荷数.
练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
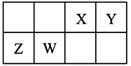
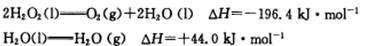
 PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表: 2CA3△H<0,反应10min达到平衡,生成0.2molCA3。
2CA3△H<0,反应10min达到平衡,生成0.2molCA3。 Cl、
Cl、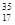 Cl为不同的核素,下列说法正确的是
Cl为不同的核素,下列说法正确的是