��Ŀ����
�±�������Ԫ�����ڱ����ֶ����ڵ�����Ԫ��
��֪RΪ�ؿ��к������Ľ���Ԫ�ء�
��1��д��Z��ԭ�ӽṹʾ��ͼ________��
��2��W����ԭ���γ�6ԭ�ӷ��ӵĽṹ��ʽ_______��
��3����ϸRX��ĩ��Ӧ���ڴ��ģ���ɵ�·����������ԭ��ΪR2Y3��X2��W�ڸ����·�Ӧ�������ֻ���������ֻ������������Ԫ����ɣ���ԭ�Ӹ����Ⱦ�Ϊ1��1���䷴Ӧ�Ļ�ѧ����ʽΪ_______��
��4��X����������Ӧˮ������X��̬�⻯�ﷴӦ������������ˮ�У�������Һ����Ũ�ȴӴ�С��˳����_______��
��5�������������ȼ����(N2H4)��������N2O4��Ӧ����N2��ˮ������
��֪��N2(g)+2O2(g)=N2O4(l) ��H1=��195kJ?mol��1
��N2H4(l) +O2(g)=N2(g)+2H2O(g) ��H2=��534.2kJ?mol��1
д���º�N2O4��Ӧ���Ȼ�ѧ����ʽ______________��
��6���¶�ΪTʱ����2.0L�����ܱ������г���1.00 mol PCl5����ӦPCl5(g)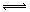 PCl3(g)+Cl2(g)������һ��ʱ�䣨t)��ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
PCl3(g)+Cl2(g)������һ��ʱ�䣨t)��ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
��ͬ�¶��£���ʼʱ�������г���1.00 mol PC15��0.20 mol PCl3��0.40 mol Cl2����Ӧ�ﵽƽ��ǰv(��) _______v(�棩���>����=����<������ԭ����_______��
| | W | X | Y | |
| R | | | | Z |
��֪RΪ�ؿ��к������Ľ���Ԫ�ء�
��1��д��Z��ԭ�ӽṹʾ��ͼ________��
��2��W����ԭ���γ�6ԭ�ӷ��ӵĽṹ��ʽ_______��
��3����ϸRX��ĩ��Ӧ���ڴ��ģ���ɵ�·����������ԭ��ΪR2Y3��X2��W�ڸ����·�Ӧ�������ֻ���������ֻ������������Ԫ����ɣ���ԭ�Ӹ����Ⱦ�Ϊ1��1���䷴Ӧ�Ļ�ѧ����ʽΪ_______��
��4��X����������Ӧˮ������X��̬�⻯�ﷴӦ������������ˮ�У�������Һ����Ũ�ȴӴ�С��˳����_______��
��5�������������ȼ����(N2H4)��������N2O4��Ӧ����N2��ˮ������
��֪��N2(g)+2O2(g)=N2O4(l) ��H1=��195kJ?mol��1
��N2H4(l) +O2(g)=N2(g)+2H2O(g) ��H2=��534.2kJ?mol��1
д���º�N2O4��Ӧ���Ȼ�ѧ����ʽ______________��
��6���¶�ΪTʱ����2.0L�����ܱ������г���1.00 mol PCl5����ӦPCl5(g)
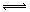 PCl3(g)+Cl2(g)������һ��ʱ�䣨t)��ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
PCl3(g)+Cl2(g)������һ��ʱ�䣨t)��ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
��ͬ�¶��£���ʼʱ�������г���1.00 mol PC15��0.20 mol PCl3��0.40 mol Cl2����Ӧ�ﵽƽ��ǰv(��) _______v(�棩���>����=����<������ԭ����_______��
��15�֣�
��1��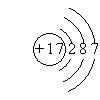 ��2�֣�
��2�֣�
��2��CH2=CH2 ��2�֣�
��3��Al2O3+N2+3C 2AlN+3CO��3�֣�
2AlN+3CO��3�֣�
��4��c(NO3��)��c(NH4+)��c(H+)��c(OH��) (˳���,©�����÷�)��2�֣�
��5��2N2H4(l) + N2O4(l)= 3N2(g) + 4H2O(g) ��H="��873.4" kJ/mol��3�֣�
��6�� ��(1��)
��ΪQc=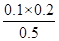 ��K=
��K= 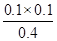 �������淴Ӧ���ʴ�������Ӧ���ʡ���2�֣�
�������淴Ӧ���ʴ�������Ӧ���ʡ���2�֣�
��1��
 ��2�֣�
��2�֣���2��CH2=CH2 ��2�֣�
��3��Al2O3+N2+3C
 2AlN+3CO��3�֣�
2AlN+3CO��3�֣���4��c(NO3��)��c(NH4+)��c(H+)��c(OH��) (˳���,©�����÷�)��2�֣�
��5��2N2H4(l) + N2O4(l)= 3N2(g) + 4H2O(g) ��H="��873.4" kJ/mol��3�֣�
��6�� ��(1��)
��ΪQc=
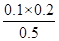 ��K=
��K= 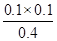 �������淴Ӧ���ʴ�������Ӧ���ʡ���2�֣�
�������淴Ӧ���ʴ�������Ӧ���ʡ���2�֣������������1���ؿ��к������Ľ���Ԫ����Al����R��W��X��Y��Z�ֱ�������̼�����������ȣ�Clԭ�Ӻ��ں˵����Ϊ+17��������Ӳ�ṹΪ287����2��̼�����γ�����6ԭ��������Ϊ��ϩ����ϩ�Ľṹ��ʽΪCH2=CH2����3���������⣬Al2O3��N2��C�ڸ����·�Ӧ����������AlN��CO����ӦʽΪAl2O3+N2+3C
 2AlN+3CO����4���������⣬HNO3��NH3��Ӧ������NH4NO3��NH4NO3���Σ����ݵ���ʵĵ��롢����ˮ����ɿ�֪����Һ��c(NO3��)��c(NH4+)��c(H+)��c(OH��)����5�����ݸ�˹���ɣ��ɢڡ�2���ٿɵã�2N2H4(l) + N2O4(l)= 3N2(g) + 4H2O(g) ��H="��873.4" kJ/mol����6������ͼ����֪��
2AlN+3CO����4���������⣬HNO3��NH3��Ӧ������NH4NO3��NH4NO3���Σ����ݵ���ʵĵ��롢����ˮ����ɿ�֪����Һ��c(NO3��)��c(NH4+)��c(H+)��c(OH��)����5�����ݸ�˹���ɣ��ɢڡ�2���ٿɵã�2N2H4(l) + N2O4(l)= 3N2(g) + 4H2O(g) ��H="��873.4" kJ/mol����6������ͼ����֪��PCl5(g)
 PCl3(g) + Cl2(g)
PCl3(g) + Cl2(g)����ֵ���ʼŨ�ȣ�mol?L��1�� 0.50 0 0
����ֵı仯Ũ�ȣ�mol?L��1�� 0.10 0.10 0.10
����ֵ�ƽ��Ũ�ȣ�mol?L��1�� 0.40 0.10 0.10
ƽ��ʱK=
 =
=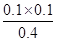
�¶Ȳ��䣬ƽ�ⳣ�����䣬����ʼʱ����1.00 mol PC15��0.20 mol PCl3��0.40 mol Cl2�������ߵ���ʼŨ��Ϊ0.5mol/L��0.10mol/L��0.20mol/L��Q=
 =
= >
>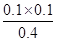 ��˵����ʱ��Ӧ�������淴Ӧ������У����ܴﵽ���¶��µĻ�ѧƽ�⣬���Դ�ʱ�淴Ӧ���ʴ�������Ӧ���ʡ�
��˵����ʱ��Ӧ�������淴Ӧ������У����ܴﵽ���¶��µĻ�ѧƽ�⣬���Դ�ʱ�淴Ӧ���ʴ�������Ӧ���ʡ�
��ϰ��ϵ�д�
 ��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
�����Ŀ
 ����
���� �������֮��Ϊ ��
�������֮��Ϊ ��