题目内容
已知2A2(g)+B2(g)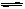 2C(g);△H=" -a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。请回答下列问题:
2C(g);△H=" -a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。请回答下列问题:
(1)比较a______b(填>、=、<)
(2)此反应的平衡常数表达式为______________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)。
(3)若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量ckJ,a、b、c之间满足何种关系__________________(用代数式表示)。
(4)能说明该反应已经达到平衡状态的是 (填序号,有一个或多个选项符合题意,下同)。
a、v(C)=2v(B2) b、容器内气体压强保持不变
c、v逆(A2)=2v正(B2) d、容器内的气体密度保持不变
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
a、及时分离出C气体 b、适当升高温度
c、增大B2的浓度 d、选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2, 500℃时充分反应达平衡后,放出热量dkJ,则d_________b(填>、=、<)。
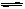 2C(g);△H=" -a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。请回答下列问题:
2C(g);△H=" -a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。请回答下列问题:(1)比较a______b(填>、=、<)
(2)此反应的平衡常数表达式为______________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)。
(3)若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量ckJ,a、b、c之间满足何种关系__________________(用代数式表示)。
(4)能说明该反应已经达到平衡状态的是 (填序号,有一个或多个选项符合题意,下同)。
a、v(C)=2v(B2) b、容器内气体压强保持不变
c、v逆(A2)=2v正(B2) d、容器内的气体密度保持不变
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
a、及时分离出C气体 b、适当升高温度
c、增大B2的浓度 d、选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2, 500℃时充分反应达平衡后,放出热量dkJ,则d_________b(填>、=、<)。
(10分)(1)a>b(1分) (2)K=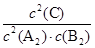 (1分);减小(1分)
(1分);减小(1分)
(3)b+c=a(2分) (4)bc(2分) (5)c(2分) (6)>(1分)
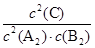 (1分);减小(1分)
(1分);减小(1分)(3)b+c=a(2分) (4)bc(2分) (5)c(2分) (6)>(1分)
试题分析:(1)由于该反应是可逆反应,因此2mol A2和1mol B2不可能完全转化为C,则实际放出的热量小于akJ,即a>b。
(2)化学平衡常数是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,所以根据方程式2A2(g)+B2(g)
 2C(g)可知,该反应的的平衡常数K=
2C(g)可知,该反应的的平衡常数K=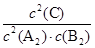 。因为该反应正反应是放热反应,升高温度,平衡向逆反应移动,平衡常数减小。
。因为该反应正反应是放热反应,升高温度,平衡向逆反应移动,平衡常数减小。(3)恒温恒容下,2molC完全转化到左边,可得2molA2和1molB2,故与原平衡为等效平衡,平衡时C的浓度相同,故c(C)=Wmol?L-1。同一可逆反应,相同温度下,正、逆反应的反应热数值相等,但符号相反,令平衡时C的物质的量为nmol,对于反应2A2(g)+B2(g)
 2C(g) △H=—akJ?mol-1,则b=n×
2C(g) △H=—akJ?mol-1,则b=n×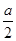 。对于反应2C(g)
。对于反应2C(g) 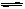 2A2(g)+B2(g) △H=akJ?mol-1,C分解的物质的量为(2—n)mol,故c=
2A2(g)+B2(g) △H=akJ?mol-1,C分解的物质的量为(2—n)mol,故c=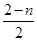 ×a=a—n×
×a=a—n×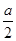 ,解得a=b+c。
,解得a=b+c。(4)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A、平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,故A错误;B、反应是气体压强减小的反应,平衡状态容器内压强保持不变,说明反应达到平衡,故B正确;C、依据反应速率之比等于化学方程式的系数之比可知,v逆(A2)=2v正(B2),说明v逆(A2)=v正(A2),故C正确;D、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,即反应过程和平衡状态容器内的密度保持不变,故D错误,答案选BC。
(5)a、及时分离出C气体,生成物浓度降低,平衡向正反应方向移动,但反应速率也降低,a不正确;b、正反应是放热反应,升高温度反应速率增大,但平衡向逆反应方向移动,b不正确;c、增大B2的浓度,反应速率增大,平衡向正反应方向移动,c正确;d、催化剂只能改变反应速率,不能改变平衡状态,d不正确,答案选c。
(6)原平衡随反应进行,压强降低.恒压容器(反应器开始体积相同),相同温度下起始加入2molA2和1molB2,等效为在原平衡的基础上增大压强,平衡向气体体积减小的方向移动,即向正反应移动,B2的转化率变大,因此d>b。

练习册系列答案
相关题目
 PCl5(g)达到平衡时,PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是
PCl5(g)达到平衡时,PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是 N2O4(g)△H<0
N2O4(g)△H<0 2O3(g)△H>0
2O3(g)△H>0 2NH3(g) △H = -92 kJ·mol-1
2NH3(g) △H = -92 kJ·mol-1
 2AB3(g) 达到平衡的标志是
2AB3(g) 达到平衡的标志是 NH3(气)+HI(气),2HI(气)
NH3(气)+HI(气),2HI(气) 2C(g) △H<0。2 min后,反应达到平衡,生成C为1.6 mol。则下列分析正确的是 ( )
2C(g) △H<0。2 min后,反应达到平衡,生成C为1.6 mol。则下列分析正确的是 ( ) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据: (4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为: 和 。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为 。(Li的相对原子质量约为7.0)
(4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为: 和 。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为 。(Li的相对原子质量约为7.0)