题目内容
17.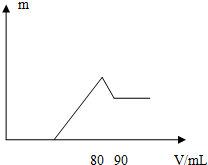 一定质量的镁、铝混合物投入2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则n(Mg)/n(Al)的最大值是( )
一定质量的镁、铝混合物投入2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则n(Mg)/n(Al)的最大值是( )| A. | 1:1 | B. | 8:1 | C. | 4:1 | D. | 5:2 |
分析 根据氢氧化钠的体积在80至90mL段内,所有的氢氧化钠用于溶解氢氧化铝,根据氢氧化钠的量确定氢氧化铝的量,根据原子守恒确定金属铝的量;根据图象中消耗的氢氧化钠的量确定合金中金属镁的最大量,进而确定该合金中两元素物质的量之比的最大值.
解答 解:根据图可知,首先发生的反应是中和过量的酸:H++OH-=H2O,然后是沉淀两种金属离子:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,最后是Al(OH)3的溶解:Al(OH)3+OH-=[Al(OH)4]-,从横坐标80mL到90mL这段可以求出n(Al(OH)3)=0.02mol,则n(Al)=n(Al(OH)3)=0.02mol,所以沉淀Al3+需要的OH-为0.06mol,即NaOH溶液的体积为30mL,
镁离子和铝离子沉淀完全消耗的碱的体积为80-a,假设盐酸不剩,所以沉淀Mg2+需要NaOH溶液的体积最大值为:80mL-30mL=50mL,则n (Mg)的最大值为:$\frac{2mol/L×0.05L}{2}$=0.05mol,
则n(Mg)/n(Al)的最大值是:0.05mol:0.02mol=5:2,
故选D.
点评 本题考查混合物的有关计算及镁、铝的化学性质等,题目难度中等,明确发生的化学反应及反应与图象的对应关系是解答本题的关键,注意利用元素守恒的方法来解答.

练习册系列答案
相关题目
7.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在1L 2 mol/L的硝酸钙溶液中含有的硝酸根离子的数目为NA | |
| B. | 标准状况下22.4L乙醇完全燃烧,生成的二氧化碳的分子数为2NA | |
| C. | 46g二氧化氮(NO2)和46g四氧化二氮(N2O4)含有的原子数均为3NA | |
| D. | 1mol氢氧根离子中含有的电子数为9NA |
5.下列有关化学与生活、工业的叙述中,正确的是( )
| A. | 工业上生产水泥、玻璃、陶瓷,均需要用石灰石为原料 | |
| B. | 石英是良好的半导体材料,可以制成光电池,将光能直接转化为电能 | |
| C. | 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物 | |
| D. | 地沟油由于混有一些对身体有害的杂质而不能食用,可加工制成生物柴油,生物柴油的成分与从石油中提取的柴油成分不同 |
12.将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中铝元素的质量与溶液中所含铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是( )
| A. | 1:3 | B. | 3:2 | C. | 1:4 | D. | 2:7 |
2.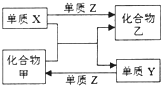 甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
 甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )| 选项 | X | Y | Z | 甲 | 乙 |
| A | C | H2 | O2 | H2O | CO |
| B | Zn | Fe | Cl2 | FeCl2 | ZnCl2 |
| C | Mg | C | O2 | CO2 | MgO |
| D | H2 | Si | Cl2 | SiCl4 | HCl |
| A. | A | B. | B | C. | C | D. | D |
9.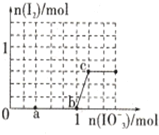 已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )
已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )
 已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )
已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )| A. | 还原性:HSO${\;}_{3}^{-}$>I-,氧化性:IO${\;}_{3}^{-}$>I2>SO${\;}_{4}^{2-}$ | |
| B. | a点处的氧化产物是SO${\;}_{4}^{2-}$,还原产物是I- | |
| C. | 当溶液中的I-为0.4mol时,加入的KIO3一定为0.4mol | |
| D. | 若向KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为:2IO${\;}_{3}^{-}$+5HSO${\;}_{3}^{-}$═I2+5SO${\;}_{4}^{2-}$+3H++H2O |
7.某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如图:

下列推断不合理的是( )

下列推断不合理的是( )
| A. | 往甲中通适量CO2有利于(NH4)2SO4生成 | |
| B. | 生成1 mol(NH4)2SO4至少消耗2 molNH3 | |
| C. | CO2可被循环利用 | |
| D. | NH3、CO2的通入顺序可以互换 |
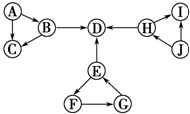 已知:①图中每个小三角形的三种物质中至少含有一种相同元素,H与I含有完全相同的元素.②A、J为固体单质,D为气体单质,其余物质为常见化合物.③B为淡黄色化合物,B与H反应能生成D.④E为常见金属氧化物.⑤F的溶液和H反应生成白色胶状沉淀G.
已知:①图中每个小三角形的三种物质中至少含有一种相同元素,H与I含有完全相同的元素.②A、J为固体单质,D为气体单质,其余物质为常见化合物.③B为淡黄色化合物,B与H反应能生成D.④E为常见金属氧化物.⑤F的溶液和H反应生成白色胶状沉淀G. .
.