题目内容
12.将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中铝元素的质量与溶液中所含铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是( )| A. | 1:3 | B. | 3:2 | C. | 1:4 | D. | 2:7 |
分析 将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,沉淀为Al(OH)3,溶液中的铝可能为AlCl3或NaAlO2,
可分别发生:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,结合反应的离子方程式分为两种情况讨论计算.
解答 解:设AlCl3和NaOH的浓度分别为c1和c2,相同体积为V,
若NaOH过量,生成NaAlO2,此时参加反应的AlCl3的物质的量是c1Vmol,NaOH是3c1Vmol,生成c1V mol 的Al(OH)3,
又因为得到的沉淀物中铝元素的质量和溶液中铝元素的质量相等,则说明第一步反应完后,生成的Al(OH)3有一半($\frac{1}{2}$c1V)发生Al(OH)3+OH-=AlO2-+2H2O,
所以可求的NaOH的物质的量为:3c1V+0.5c1V=3.5c1V=c2V,所以c1:c2=2:7;
当氯化铝过量时,氢氧化钠不足,生成氢氧化铝白色沉淀发生反应:Al3++3OH-═Al(OH)3↓,设反应掉的铝离子物质的量为x,得到的沉淀物中铝元素的质量和溶液中铝元素的质量相等,则c1V-x=x,所以x=0.5c1V,消耗氢氧化钠3x,即1.5c1Vmol,所以1.5c1V=c2V,所以此时c1:c2=2:3.
故选D.
点评 本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型,注意根据题给信息以及反应的相关方程式解答该题,难度中等.

练习册系列答案
相关题目
2. 如图表示的是A、B、C三种溶液两两混合发生反应的实验现象,符合该实验现象的A、B、C三种溶液依次是( )
如图表示的是A、B、C三种溶液两两混合发生反应的实验现象,符合该实验现象的A、B、C三种溶液依次是( )
 如图表示的是A、B、C三种溶液两两混合发生反应的实验现象,符合该实验现象的A、B、C三种溶液依次是( )
如图表示的是A、B、C三种溶液两两混合发生反应的实验现象,符合该实验现象的A、B、C三种溶液依次是( )| A. | 盐酸、碳酸钠溶液、氢氧化钠溶液 | |
| B. | 氯化钠溶液、澄清石灰水、氢氧化钠溶液 | |
| C. | 盐酸、碳酸钠溶液、澄清石灰水 | |
| D. | 氢氧化钙溶液、盐酸、硫酸钠溶液 |
3.某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
回答下列问题:
(1)写出醋酸的电离方程式:CH3COOH?CH3COO-+H+.
(2)醋酸溶液中存在的微粒有H2O、CH3COOH、CH3COO-、H+、OH-.
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是当醋酸浓度为0.001mol/L时,溶液中的氢离子浓度小于0.001mol/L.
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度(选填“增大”“减小”或“不变”)增大.
(5)常温常压下,在 pH=5的稀醋酸溶液中,c(CH3COO-)=(10-5-10-9)mol/L (精确值,用表达式表示).
(6)下列方法中,可以使0.10mol•L-1CH3COOH溶液中CH3COOH电离程度增大的是de.
a.加入少量0.10mol•L-1的稀盐酸 b.加入少量冰醋酸
c.加入少量氯化钠固体 d.加热CH3COOH溶液
e.加入Zn粒 f.加入少量0.10mol•L-1的CH3COONa溶液.
| 醋酸浓度/mol•L-1 | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(1)写出醋酸的电离方程式:CH3COOH?CH3COO-+H+.
(2)醋酸溶液中存在的微粒有H2O、CH3COOH、CH3COO-、H+、OH-.
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是当醋酸浓度为0.001mol/L时,溶液中的氢离子浓度小于0.001mol/L.
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度(选填“增大”“减小”或“不变”)增大.
(5)常温常压下,在 pH=5的稀醋酸溶液中,c(CH3COO-)=(10-5-10-9)mol/L (精确值,用表达式表示).
(6)下列方法中,可以使0.10mol•L-1CH3COOH溶液中CH3COOH电离程度增大的是de.
a.加入少量0.10mol•L-1的稀盐酸 b.加入少量冰醋酸
c.加入少量氯化钠固体 d.加热CH3COOH溶液
e.加入Zn粒 f.加入少量0.10mol•L-1的CH3COONa溶液.
7.下列有关物质的性质和应用正确的是( )
| A. | NH3能氧化氮氧化物,可用于汽车尾气净化 | |
| B. | Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物 | |
| C. | Fe在氧气中的燃烧产物可用于制红色涂料 | |
| D. | Mg(OH)2分解吸热且生成高熔点固体,可作阻燃剂 |
17.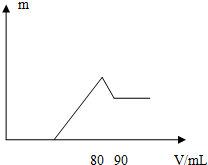 一定质量的镁、铝混合物投入2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则n(Mg)/n(Al)的最大值是( )
一定质量的镁、铝混合物投入2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则n(Mg)/n(Al)的最大值是( )
 一定质量的镁、铝混合物投入2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则n(Mg)/n(Al)的最大值是( )
一定质量的镁、铝混合物投入2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则n(Mg)/n(Al)的最大值是( )| A. | 1:1 | B. | 8:1 | C. | 4:1 | D. | 5:2 |
4.下列各组离子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式正确的是( )
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | Fe2+、NO${\;}_{3}^{-}$、NH${\;}_{4}^{+}$ | NaHSO4溶液 | 3Fe${\;}^{2{+}_{\;}^{\;}}$+NO${\;}_{3}^{-}$+4H+═3Fe3++NO↑+2H2O |
| B | Ca2+、HCO${\;}_{3}^{-}$、Cl- | 少量NaOH溶液 | Ca2++2HCO${\;}_{3}^{-}$+2OH-═2H2O+CaCO3↓+CO${\;}_{3}^{2-}$ |
| C | K+、AlO${\;}_{2}^{-}$、HCO${\;}_{3}^{-}$ | 通入少量CO2 | 2AlO${\;}_{2}^{-}$+3H2O+CO2═2Al(OH)3↓+CO${\;}_{3}^{2-}$ |
| D | NH${\;}_{4}^{+}$、Al3+、SO${\;}_{4}^{2-}$ | 少量Ba(OH)2溶液 | 2NH${\;}_{4}^{+}$+SO${\;}_{4}^{2-}$+Ba2++2OH-═BaSO4↓+2NH3.H2O |
| A. | A | B. | B | C. | C | D. | D |

 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.