题目内容
【题目】铝石墨双离子电池是一种全新低成本、高效电池。原理为:A1Li+Cx(PF6)![]() Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是
Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是
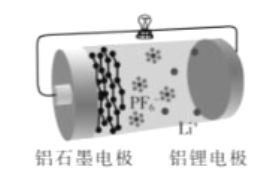
A. 放电时,外电路中电子向铝锂电极移动
B. 放电时,正极反应为Cx(PF6)+e-=xC+PF6-
C. 充电时,应将铝石墨电极与电源负极相连
D. 充电时,若电路中通过1 mol电子,阴极质量增加9 g
【答案】B
【解析】A. 放电时铝锂电极中锂失电子作为负极,外电路中电子由负极铝锂电极向正极铝石墨移动,选项A错误;B. 放电时正极铝石墨电极Cx(PF6)得电子产生PF6-,电极反应为Cx(PF6)+e-= xC+ PF6-,选项B正确;C. 充电时,应将铝石墨电极与电源正极相连,选项C错误;D. 充电时,根据电极反应Li++ Al +e-= AlLi可知,若电路中转移l mol电子,阴极质量增加36g,选项D错误。答案选B。

【题目】(1)某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1 mol·L1 FeCl3溶液、0.1 mol·L1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
①用所给试剂写出体现Fe2+具有还原性的反应的化学方程式:_________________________________。
②设计实验方案,完成下列表格。
探究内容 | 实验方案 | 实验现象 |
探究Fe3+具有氧化性 | 取少量0.1 mol·L1 FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 | 加入铁粉后,溶液颜色变为________。加入KSCN溶液后,溶液________ |
③该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为_________________________________________。
(2)某反应中反应物与生成物有Fe3+、Mn2+、H+、![]() 、H2O和一种未知离子X,已知
、H2O和一种未知离子X,已知![]() 在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
(3)有一铁的氧化物样品,用5 mol·L1的盐酸140 mL恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为________。