��Ŀ����
����Ŀ����������ѧ��־�����������³ƣ�һ����̼������Ӧʹ�õĽ��������︴�ϴ��������ȡ���ش��չ��һ����̼������Ӧ����-����ͭ�������ɶ�����̼����ͼ1��ʾ��
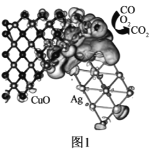
�ش��������⣺
��1��Ag�����ڱ���λ��Cu���ڸ������һ���ڣ��۵�����Ŀ��ͭ��ȫ��ͬ����̬Agԭ�ӵļ۵����Ų�ͼΪ__��
��2��CO��N2��Ϊ�ȵ����壬��CO�ĵ���ʽΪ__��д��һ����CO��Ϊ�ȵ�����������ӵ����ӷ���__��C��N��O����Ԫ���е�һ����������Ϊ__(��Ԫ�ط���)��CO��Ni�ڸ����¿�������Ni(CO)4��Ni(CO)4��Ni��d�����10���ӹ��ͣ���4s�������������Ҳ����3d���������s�����p����γ��ĸ��ӻ�����������ӻ���ʽΪ__�ӻ����ݴ��Ʋ�Ni(CO)4�Ŀռ乹��Ϊ__��Ni��CO֮��Ļ�ѧ��Ϊ__��
��3��һЩ��������۵��������±���ʾ��

����������֮���۵�����ԭ��Ϊ__��
��4���������ľ�����ͼ2��ʾ��
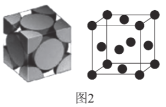
�پ������Ķѻ���ʽΪ__��
����NA��ʾ�����ӵ�������ֵ��Mg��mol-1��ʾ����Ħ��������dcm��ʾ��ԭ�ӵ�ֱ�������������ܶȿɱ�ʾΪ__g��cm-3(�ú�NA��M��d�Ĵ���ʽ��ʾ)��
���𰸡�![]()
![]() CN�� N sp3 �������� ��λ�� CO2��CO�Ƿ��Ӿ��壬CuO��MgO�����Ӿ��壬���Ӿ����۵�С�����Ӿ��壬���Ӿ�������Է�������Խ���»���Խ���۵�Խ�ߣ����Ӿ�����Mg2+�뾶��Cu2+�뾶С��MgO�����̣�MgO�����ܴ��۵�� ��������
CN�� N sp3 �������� ��λ�� CO2��CO�Ƿ��Ӿ��壬CuO��MgO�����Ӿ��壬���Ӿ����۵�С�����Ӿ��壬���Ӿ�������Է�������Խ���»���Խ���۵�Խ�ߣ����Ӿ�����Mg2+�뾶��Cu2+�뾶С��MgO�����̣�MgO�����ܴ��۵�� �������� ![]()
��������
��Ag�����ڱ���λ��Cu���ڸ������һ���ڣ��۵�����Ŀ��ͭ��ȫ��ͬ��Cu�۵���Ϊ3d104s1��
��CO��N2��Ϊ�ȵ����壬N2�ǹ������Ե��ӣ����ݼ۵��ӹ�ϵN����O��ͬ��ͬ���ڵ��������������ƣ�����VA����ڵ�VIA��Ԫ�أ�Ni����s�����p����γ��ĸ��ӻ�����ó��ӻ���ʽ���Ӷ��Ƴ�Ni(CO)4�Ŀռ乹�ͺ�Ni��CO֮��Ļ�ѧ����
�DZ���������֮���۵�����ԭ��ΪCO2��CO�Ƿ��Ӿ��壬CuO��MgO�����Ӿ��壬M�ֱ�����۵��Сԭ��
�Ȣپ��������������ĺͶ����ϣ����ȼ����ⳤ���ټ���һ������������ԭ�Ӹ������ټ��㾧�������ܶȡ�
��Ag�����ڱ���λ��Cu���ڸ������һ���ڣ��۵�����Ŀ��ͭ��ȫ��ͬ��Cu�۵���Ϊ3d104s1����˻�̬Agԭ�ӵļ۵���Ϊ4d105s1����̬Agԭ�ӵļ۵����Ų�ͼΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��CO��N2��Ϊ�ȵ����壬N2�ǹ������Ե��ӣ������CO�ĵ���ʽΪ![]() �����ݼ۵��ӹ�ϵN��=O�������CO��Ϊ�ȵ�����������ӵ����ӷ���CN����ͬ���ڵ��������������ƣ�����VA����ڵ�VIA��Ԫ�أ�C��N��O����Ԫ���е�һ����������ΪN��CO��Ni�ڸ����¿�������Ni(CO)4��Ni(CO)4��Ni��d�����10���ӹ��ͣ���4s�������������Ҳ����3d���������s�����p����γ��ĸ��ӻ�����������ӻ���ʽΪsp3�ӻ����ݴ��Ʋ�Ni(CO)4�Ŀռ乹��Ϊ�������Σ�Ni��CO֮��Ļ�ѧ��Ϊ��λ�����ʴ�Ϊ��
�����ݼ۵��ӹ�ϵN��=O�������CO��Ϊ�ȵ�����������ӵ����ӷ���CN����ͬ���ڵ��������������ƣ�����VA����ڵ�VIA��Ԫ�أ�C��N��O����Ԫ���е�һ����������ΪN��CO��Ni�ڸ����¿�������Ni(CO)4��Ni(CO)4��Ni��d�����10���ӹ��ͣ���4s�������������Ҳ����3d���������s�����p����γ��ĸ��ӻ�����������ӻ���ʽΪsp3�ӻ����ݴ��Ʋ�Ni(CO)4�Ŀռ乹��Ϊ�������Σ�Ni��CO֮��Ļ�ѧ��Ϊ��λ�����ʴ�Ϊ��![]() ��CN����N��sp3���������Σ���λ����
��CN����N��sp3���������������
�DZ���������֮���۵�����ԭ��ΪCO2��CO�Ƿ��Ӿ��壬��Է�������Խ���»���Խ���۵�Խ�ߣ�CuO��MgO�����Ӿ��壬Mg2+�뾶��Cu2+�뾶С��MgO�����̣�MgO�����ܴ��۵�ߣ��ʴ�Ϊ��CO2��CO�Ƿ��Ӿ��壬CuO��MgO�����Ӿ��壬���Ӿ����۵�С�����Ӿ��壬���Ӿ�������Է�������Խ���»���Խ���۵�Խ�ߣ����Ӿ�����Mg2+�뾶��Cu2+�뾶С��MgO�����̣�MgO�����ܴ��۵�ߡ�
�Ȣپ��������������ĺͶ����ϣ�������Ķѻ���ʽΪ�����������ʴ�Ϊ������������
����NA��ʾ�����ӵ�������ֵ��Mg��mol-1��ʾ����Ħ��������dcm��ʾ��ԭ�ӵ�ֱ�������ⳤΪa�����![]() ��
��![]() ��һ������������ԭ�Ӹ���Ϊ
��һ������������ԭ�Ӹ���Ϊ![]() �����������ܶȿɱ�ʾΪ
�����������ܶȿɱ�ʾΪ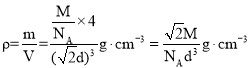 ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��