题目内容
【题目】煤的主要组成元素是碳、氢、氧、硫、氮,还有极少量的磷、砷、锗、镓、铟等元素,燃煤产生CxHy、SO2等大气污染物,煤的气化是高效、清洁利用煤炭的重要途径之一。回答下列问题:
(1)锗是第四周期第ⅣA族元素,其原子结构示意图为_______________________。
(2)利用煤的气化获得的水煤气(主要成分为CO、CO2和H2)在催化剂作用下可以合成绿色燃料甲醇。
已知:H2O(l)=H2O(g) △H1=+44.0kJ/mol
CO2(g)+H2(g)=CO(g)+H2O(l) △H2=-3.0 kJ/mol
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3=-58.7 kJ/mol
写出由CO 与 H2制备 CH3OH 气体的热化学方程式___________________________________。
(3)甲醇和CO2可直接合成碳酸二甲酯(CH3OCOOCH3,简称DMC) :
2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+H2O(g) ΔH4<0
CH3OCOOCH3(g)+H2O(g) ΔH4<0
①该化学反应的平衡常数表达式为K=_________________________。
②在恒温恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是_____________(填标号)。
A.v正(CH3OH)= 2v逆(H2O) B.容器内气体的密度不变
C.容器内压强不变 D.CH3OH与CO2的物质的量之比保持不变
③一定条件下分别向甲、乙丙个恒容密团容器中加入一定量的初始物质发生该反应,各容器中温度、反应物的起始量如下表,反应过程中DMC的物质的量依度随时间变化如下图所示:
容器 | 甲 | 乙 | 丙 |
容积(L) | 0.5 | 0.5 | V |
温度(℃) | T1 | T2 | T1 |
起始量 | 1molCO2(g)2molCH3OH(g) | 1molDMC(g)1mol H2O (g) | 2molCO2(g)2molCH3OH(g) |
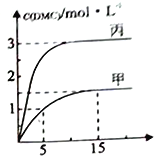
甲容器中,在5-15min中的平均反应速率v(CO2) =_____________。乙容器中,若平衡时n(CO2) =0.2mol,则T1________T2(填“>”“<"或”=”)。甲、丙两容器的反应达平衡时CO2的转化率:甲________丙(填“>”“<"或”=”)。
(4)一定温度下,用水吸收SO2气体时,溶液中水的电离平衡_________移动(填“向左” “向右”或“不”);若得到pH=4的H2SO3溶液,试计算溶液中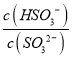 =____________。SO2可用足量小苏打溶液吸收,反应的离子方程式是_________________________________。(已知该温度下,H2SO3的电离常数:K1=4.5×10-2,K2=2.5×10-7,H2CO3的电离常数K1=8.4×10-7,K2=1.2×10-10)
=____________。SO2可用足量小苏打溶液吸收,反应的离子方程式是_________________________________。(已知该温度下,H2SO3的电离常数:K1=4.5×10-2,K2=2.5×10-7,H2CO3的电离常数K1=8.4×10-7,K2=1.2×10-10)
【答案】 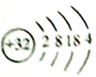 CO(g)+2H2(g)=CH3OH(g) ΔH=-99.7kJ·mol-1
CO(g)+2H2(g)=CH3OH(g) ΔH=-99.7kJ·mol-1 ![]() AC 0.05mol·L-l·min-1 > > 向左 400 HCO3-+SO2=HSO3-+CO2
AC 0.05mol·L-l·min-1 > > 向左 400 HCO3-+SO2=HSO3-+CO2
【解析】(1)锗是第四周期第ⅣA族元素,其原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)已知:①H2O(l)=H2O(g) △H1=+44.0kJ/mol,②CO2(g)+H2(g)=CO(g)+H2O(l) △H2=-3.0 kJ/mol,③CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3=-58.7 kJ/mol,根据盖斯定律计算③-①-②得到CO 与 H2生成 CH3OH 气体反应的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-99.7 kJmol-1,故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-99.7kJmol-1;
(3)2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+H2O(g) ΔH4<0。
CH3OCOOCH3(g)+H2O(g) ΔH4<0。
①化学平衡常数等于平衡时生成物的浓度幂之积比上反应物浓度幂之积,K=![]() ,故答案为:K=
,故答案为:K=![]() ;
;
②A.v正(CH3OH)= 2v逆(H2O),表示正逆反应速率相等,能说明反应达到平衡状态,正确; B.容器的体积不变,气体的质量不变,容器内气体的密度始终不变,不能说明反应达到平衡状态,错误;C.反应恰好气体的物质的量发生变化,容器内压强不变,说明各物质的量不变,能说明反应达到平衡状态,正确; D.CH3OH与CO2的物质的量之比与反应前加入的物质的量有关,平衡时CH3OCOOCH3与H2O的物质的量之比可能保持不变,也可能变化,不能说明反应达到平衡状态,错误;故选AC;
③甲容器中,在5-15min中的平均反应速率v(CO2)= v(DMC) =![]() =
=![]() =0.05 mol·L-l·min-1;根据表格数据,n(CO2)减小,平衡正向移动,因此是降温的结果,因此T1>T2;甲、丙两容器相比,丙中加入了二氧化碳,平衡正向移动,但二氧化碳的转化率降低,即平衡时CO2的转化率:甲>丙,故答案为:0.05mol·L-l·min-1;>;>;
=0.05 mol·L-l·min-1;根据表格数据,n(CO2)减小,平衡正向移动,因此是降温的结果,因此T1>T2;甲、丙两容器相比,丙中加入了二氧化碳,平衡正向移动,但二氧化碳的转化率降低,即平衡时CO2的转化率:甲>丙,故答案为:0.05mol·L-l·min-1;>;>;
(4)二氧化硫和水反应生成亚硫酸,亚硫酸电离生成氢离子导致溶液中氢离子浓度增大,从而抑制水电离,即水的电离平衡向逆反应方向移动; 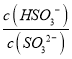 =
=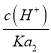 =
=![]() =400;根据电离平衡常数可知,亚硫酸氢根离子的酸性小于碳酸,SO2可用足量小苏打溶液吸收,反应生成二氧化碳和亚硫酸氢根离子,反应的离子方程式为HCO3-+SO2=HSO3-+CO2,故答案为:向左;400;HCO3-+SO2=HSO3-+CO2。
=400;根据电离平衡常数可知,亚硫酸氢根离子的酸性小于碳酸,SO2可用足量小苏打溶液吸收,反应生成二氧化碳和亚硫酸氢根离子,反应的离子方程式为HCO3-+SO2=HSO3-+CO2,故答案为:向左;400;HCO3-+SO2=HSO3-+CO2。

 名校课堂系列答案
名校课堂系列答案
