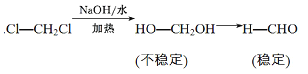
题目内容
【题目】含有相同数目氧原子的NO、CO2、N2O4三种气体,其物质的量之比为
A.1:2:4B.1:1:1C.4:2:1D.2:1:4
【答案】C
【解析】
含有相同数目氧原子,也就是氧原子的物质的量相等,设氧原子的物质的量为4amol,则NO为4amol,CO2为2amol,N2O4为amol,所以NO、CO2、N2O4的物质的量之比为4:2:1,故选C。

练习册系列答案
相关题目
【题目】(本题共10分)
在 1.0L恒容密闭容器中放入0.10 mol A (g),在一定温度进行如下反应。
A(g) ![]() 2B(g) + C(g) + D(s) △H =+85.1 kJ / mol
2B(g) + C(g) + D(s) △H =+85.1 kJ / mol
容器内气体总压强(P)与起始压强P0的比值随反应时间(t)变化数据见下表(提示:密闭容器中的压强比等于气体物质的量之比)。
时间t/min | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
P/P0 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列问题:
(1)该反应的平衡常数表达式K= 。
(2)0~2 min内的平均反应速率v(B)= 。
(3)下列能提高 A 的转化率的是 。
A.升高温度 B.向体系中通入A气体
C.减少D的物质的量 D.向体系中通入稀有气体He
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则 D 的取值范围n (D) mol 。
(5)将容器改为恒压容器,改变条件,使反应达到相同的限度,则达到平衡时 B 的浓度为 。(保留三位有效数字)。