题目内容
X、Y、Z、W是元素周期表中前四周期原予序数依次增火的四种元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的基态原子核外只有三个能级,且各能级电子数相等 |
|
Y |
Y的基态原子最外层电子数是其内层电子总数的3倍 |
|
Z |
Z的基态原子价电于排布为nsn-1 |
|
W |
W的单质是一种常见的红色金属,在潮湿的空气中易生成绿色的锈斑 |
(1)W位于元素周期表第 周期第 族,其基态原子核外有 个未成对电子。
(2)与Z同周期且依次相邻的两种元素的原子与Z比较,三者第一电离能的大小顺序为
[用元素符号表示];Y的氢化物在同族的氢化物中沸点反常,其原因是 。
(3)写出W的单质在潮湿的空气中生成绿色锈斑的化学方程式,并标出电子转移的方向和数目 。
(4)往X、Y与氢三种元素组成的多种分子中,有些分子的核磁共振氢谱显示有三种氢,且数目比为1:2:3,写出其中一种分子的名称 。X、Y可以形成多种弱酸根离子,写出其中一种离子水解的的离子方程式
(16分)
(1)四(1分)ⅠB(1分) 1(2分)
(2)Ⅰ1(Mg) >Ⅰ1(Al)> Ⅰ1(Na) (2分) H2O分子间存在氢键(2分)
(3)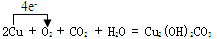 (方程式2分,电子转移的方向和数目2分,单线桥或双线桥表示均可)
(方程式2分,电子转移的方向和数目2分,单线桥或双线桥表示均可)
(4)乙醇(2分)(其它合理答案均给分,不是名称不给分),CO32-+H2O HCO3-+OH-
HCO3-+OH-
(或 C2O42-+H2O HC2O4-+OH-等合理答案均给分)(2分)
HC2O4-+OH-等合理答案均给分)(2分)
【解析】
试题分析:根据题意可以推知,X、Y、Z、W分别为C、O、Mg、Cu;
(1)Cu的原子序数为29,在第四周期第ⅠB族,电子排布式为[Ar]3d104s1,故有1个未成对电子;
(2)同周期从左到右,第一电离能依次增大,H2O中存在氢键,故沸点反常;
(3)绿斑为碱式碳酸铜,故为铜与空气中氧气、二氧化碳、水反应得到;
(4)为C、H、O三种元素的化合物可发挥性很大,可以从简单、常见物质着手考虑。
考点:以物质结构为基础,考查了原子结构、分子结构,元素周期表及元素周期律以及元素及化合物知识。