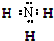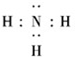题目内容
已知X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
(1)X位于元素周期表的第 周期 族;元素X与Y形成的简单化合物中含有的化学键的类型是 ,常温下形成的晶体类型是 晶体.
(2)Y、Z两种元素中原子半径较小的是 (填元素符号),Y元素所在周期中电负性最大的元素符号是 .
(3)W的单质与足量X的最高价氧化物的水化物的浓溶液反应的化学方程式为 ,若生成标准状况下的气体11.2L,则反应中转移电子的物质的量为 mol.
(4)已知:Ksp(ZnZ)>>Ksp(WZ),则向含有等物质的量浓度的Zn2+外和W2+的稀溶液中滴加Y2Z溶液,最先沉淀的化合物的名称是 .
(5)已知:4XH3(g)+5O2(g)=4XO(g)+6H2O(g)△H=-905kJ?mol-14XH3(g)+3O2(g)=2X2(g)+6H2O(g)△H=-1268kJ?mol-1
则:x2(g)+O2(g)=2XO(g)的△H kJ?mol-1.
| 元素编号 | 相关信息 |
| X | X的一种核素质量数为14,中子数为7 |
| Y | Y的过氧化物是一种淡黄色固体,可用作供氧剂 |
| Z | Z的基态原子M层电子数比L层少2个 |
| W | W的基态原子的价电子排布式为3d104sl |
(2)Y、Z两种元素中原子半径较小的是
(3)W的单质与足量X的最高价氧化物的水化物的浓溶液反应的化学方程式为
(4)已知:Ksp(ZnZ)>>Ksp(WZ),则向含有等物质的量浓度的Zn2+外和W2+的稀溶液中滴加Y2Z溶液,最先沉淀的化合物的名称是
(5)已知:4XH3(g)+5O2(g)=4XO(g)+6H2O(g)△H=-905kJ?mol-14XH3(g)+3O2(g)=2X2(g)+6H2O(g)△H=-1268kJ?mol-1
则:x2(g)+O2(g)=2XO(g)的△H
分析:X、Y、Z、W是元素周期表前四周期中的常见元素,X的一种核素质量数为14,中子数为7,则其质子数=14-7=7,故X为N元素;Y的过氧化物是一种淡黄色固体,可用作供氧剂,则Y为Na;Z的基态原子M层电子数比L层少2个,则其M层电子数=8-2=6,故Z为S元素;W的基态原子的价电子排布式为3d104sl,则W为Cu,据此解答.
解答:解:X、Y、Z、W是元素周期表前四周期中的常见元素,X的一种核素质量数为14,中子数为7,则其质子数=14-7=7,故X为N元素;Y的过氧化物是一种淡黄色固体,可用作供氧剂,则Y为Na;Z的基态原子M层电子数比L层少2个,则其M层电子数=8-2=6,故Z为S元素;W的基态原子的价电子排布式为3d104sl,则W为Cu,
(1)X为氮元素,处于第二周期ⅤA族;元素N与Na形成的简单化合物为Na3N,含有离子键,属于离子晶体,
故答案为:二、ⅤA;离子键;离子;
(2)同周期自左而右原子半径减小,原子半径Na>S,同周期随原子序数增大电负性增大,故第三周期中Cl元素电负性最大,
故答案为:S;Cl;
(3)Cu与足量浓硝酸反应生成硝酸铜、二氧化氮与水,反应化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,若生成标准状况下的气体11.2L,则二氧化氮的物质的量=
=0.5mol,则反应中转移电子的物质的量=0.5mol×(5-4)=0.5mol,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;0.5;
(4)已知:Ksp(ZnS)>Ksp(CuS),CuS的溶解的更小,则向含有等物质的量浓度的Zn2+外和Cu2+的稀溶液中滴加Na2S溶液,最先沉淀的化合物是硫化铜,
故答案为:硫化铜;
(5)已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905kJ?mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1268kJ?mol-1
根据盖斯定律,(①-②)×
得:N2(g)+O2(g)=2NO(g),则其△H=
×[(-905kJ?mol-1)-(-1268kJ?mol-1)]=+181.5kJ?mol-1,
故答案为:+181.5.
(1)X为氮元素,处于第二周期ⅤA族;元素N与Na形成的简单化合物为Na3N,含有离子键,属于离子晶体,
故答案为:二、ⅤA;离子键;离子;
(2)同周期自左而右原子半径减小,原子半径Na>S,同周期随原子序数增大电负性增大,故第三周期中Cl元素电负性最大,
故答案为:S;Cl;
(3)Cu与足量浓硝酸反应生成硝酸铜、二氧化氮与水,反应化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,若生成标准状况下的气体11.2L,则二氧化氮的物质的量=
| 11.2L |
| 22.4L/mol |
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;0.5;
(4)已知:Ksp(ZnS)>Ksp(CuS),CuS的溶解的更小,则向含有等物质的量浓度的Zn2+外和Cu2+的稀溶液中滴加Na2S溶液,最先沉淀的化合物是硫化铜,
故答案为:硫化铜;
(5)已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905kJ?mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1268kJ?mol-1
根据盖斯定律,(①-②)×
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:+181.5.
点评:本题考查结构性质位置关系应用、元素周期律、反应热计算、溶度积应用等,难度不大,注意基础知识的掌握.

练习册系列答案
相关题目

 已知X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大,X元素原子价电子排布式为ns1,Y元素是空气中含量最多的元素,Z 与W同主族,而且W原子的电子排布式中,p轨道上只有1个未成对电子.
已知X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大,X元素原子价电子排布式为ns1,Y元素是空气中含量最多的元素,Z 与W同主族,而且W原子的电子排布式中,p轨道上只有1个未成对电子.