题目内容
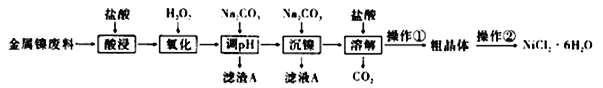
【题目】NiCl2是化工合成中最重要的镍源,在实验室中模拟工业上利用金属镍废料(含镍、铁、铝)生产氯化镍晶体(NiCl2·6H2O)流程如下:
下表列出了相关金属离子生产氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Al(OH)3 |
开始沉淀的pH | 7.6 | 2.7 | 7.1 | 3.7 |
沉淀完全的pH | 9.6 | 3.7 | 9.2 | 4.7 |
回答下列问题:
(1)加入H2O2氧化时发生反应的离子方程式为______,调pH的范围为_______,若调pH=6,则溶液中c(Al3+):c(Fe3+)=________。(已知Ksp[Al(OH)3]=1×10-34,Ksp[Fe(OH)3]=1×10-38)
(2)滤液A的溶质主要是_______。
(3)操作①的实验方法依次是_________、冷却结晶、过滤、洗涤、干燥。
【答案】2Fe2++H2O2+2H+=2Fe3++2H2O 4.7≤pH<7.1 10000:1 NaCl和Na2CO3 蒸发浓缩
【解析】
利用金属镍废料(含镍、铁、铝)生产氯化镍晶体(NiCl26H2O),由流程可知,加盐酸酸浸后的酸性溶液中主要含有Ni2+、Cl-,还含有少量Fe2+、Al3+,加入过氧化氢,氧化Fe2+为Fe3+,加入Na2CO3溶液调节溶液的pH,使Fe3+、Al3+全部沉淀,滤渣A为Fe(OH)3和Al(OH)3,再向滤液中加入Na2CO3溶液可以沉淀Ni2+得NiCO3,滤液A含NaCl和Na2CO3,将NiCO3再溶于盐酸,得NiCl2溶液,操作①为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,操作②为重结晶,将得到的氯化镍晶体重新溶解,再进行结晶,从而得到NiCl26H2O,以此来解答。
(1) H2O2具有强的氧化性,加入H2O2氧化,可将溶液中的Fe2+转化为Fe3+,该反应离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;第一次加入Na2CO3溶液调pH的目的是将Fe3+和Al3+都转化为金属氢氧化物,形成Fe(OH)3和Al(OH)3沉淀除去,而Ni2+不能沉淀,结合表中数据可知pH的范围是4.7≤pH<7.1;当溶液的pH=6时,Fe(OH)3和Al(OH)3都沉淀完全,由于二者的化合物构型相同,所以溶液中c(Al3+):c(Fe3+)=Ksp[Al(OH)3]:Ksp[Fe(OH)3]=( 1×10-34):(1×10-38)=10000:1;
(2)第二次加Na2CO3沉镍,过滤,得到滤液A的溶质主要是NaCl和Na2CO3;
(3)操作①的实验方法是蒸发浓缩、冷却结晶、过滤、洗涤、干燥。

 阅读快车系列答案
阅读快车系列答案







