题目内容
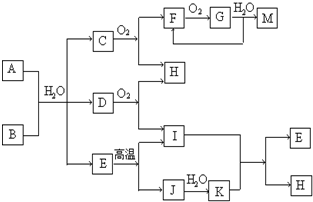
已知:A为酸式盐,B为某二价主族金属元素的化合物,其中B的化学式中共有32个电子,常温常压下C、D、F、G、I均呈气态,除G呈红棕色外其他气体均为无色.等物质的量A、B与少量的水充分混合能恰好完全反应.图中反应条件(除高温外)均已略去.
(1)写出B的电子式
(2)写出下列反应的离子方程式:
①在A溶液中加入M:
②向A溶液中加入过量NaOH溶液,并加热:
(3)M与组成B的非金属元素的单质反应的化学方程式为:
(4)第三周期中,正负化合价之和为4的元素X.写出X的氢化物与其低价氧化物反应的方程式: ;地壳中含量最多的金属的单质与短周期元素形成的最强的碱反应的离子方程式为: .
(5)写出A与B反应的化学方程式 .

(1)写出B的电子式
(2)写出下列反应的离子方程式:
①在A溶液中加入M:
②向A溶液中加入过量NaOH溶液,并加热:
(3)M与组成B的非金属元素的单质反应的化学方程式为:
(4)第三周期中,正负化合价之和为4的元素X.写出X的氢化物与其低价氧化物反应的方程式:
(5)写出A与B反应的化学方程式
分析:G呈红棕色气体,应为NO2,与水反应生成M、F,由转化C
F
G,且C、F均呈气态,可知C为NH3、F为NO,G为NO2、M为HNO3,由C+O2→F+H,可知H为H2O.由A+B+少量H2O→NH3+D+E,结合A为酸式盐,B为某二价主族金属元素的化合物,A为酸式铵盐,B与水作用生成气体与碱,考虑CaC2+H2O→Ca(OH)2+C2H2↑,CaC2中共有32个电子,故B为CaC2,再结合A+B+少量H2O→NH3+D+E,D为C2H2,E中为钙盐,D+O2→I+H,由于H为H2O,故I为CO2,由E
I+J,故E为CaCO3,J为CaO,故A为NH4HCO3,由J
K,故K为Ca(OH)2.I+K→E+H为CO2+Ca(OH)2→CaCO3+H2O,A+B+少量H2O→NH3+D+E,相当于CaC2+H2O→Ca(OH)2+C2H2↑,NH4HCO3+Ca(OH)2→CaCO3+NH3+H2O,等物质的量A、B恰好反应,少量的水起引发反应作用,验证符合转化关系,以此解答该题.
| 氧气 |
| 氧气 |
| 高温 |
| H2O |
解答:解:G呈红棕色气体,应为NO2,与水反应生成M、F,由转化C
F
G,且C、F均呈气态,可知C为NH3、F为NO,G为NO2、M为HNO3,由C+O2→F+H,可知H为H2O.由A+B+少量H2O→NH3+D+E,结合A为酸式盐,B为某二价主族金属元素的化合物,A为酸式铵盐,B与水作用生成气体与碱,考虑CaC2+H2O→Ca(OH)2+C2H2↑,CaC2中共有32个电子,故B为CaC2,再结合A+B+少量H2O→NH3+D+E,D为C2H2,E中为钙盐,D+O2→I+H,由于H为H2O,故I为CO2,由E
I+J,故E为CaCO3,J为CaO,故A为NH4HCO3,由J
K,故K为Ca(OH)2.I+K→E+H为CO2+Ca(OH)2→CaCO3+H2O,A+B+少量H2O→NH3+D+E,相当于CaC2+H2O→Ca(OH)2+C2H2↑,NH4HCO3+Ca(OH)2→CaCO3+NH3+H2O,等物质的量A、B恰好反应,少量的水起引发反应作用,验证符合转化关系,
(1)由上述分析可知,B为CaC2,其电子式为: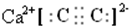 ,
,
故答案为: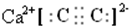 ;
;
(2))①在A溶液中加入M,为NH4HCO3与HNO3反应生成硝酸铵、二氧化碳、水,反应离子方程式为:HCO3-+H+=H2O+CO2↑,
故答案为:HCO3-+H+=H2O+CO2↑;
②向A溶液中加入过量NaOH溶液,为NH4HCO3与NaOH反应生成氨气、碳酸钠、水,反应离子方程式为:NH4++HCO3-+2OH-=NH3↑+2H2O+CO32-;
故答案为:NH4++HCO3-+2OH-=NH3↑+2H2O+CO32-;
(3)M为硝酸,组成B的非金属元素的单质为碳,碳与硝酸反应的化学方程式为:C+4HNO3(浓)
4NO2↑+CO2↑+2H2O,
故答案为:C+4HNO3(浓)
4NO2↑+CO2↑+2H2O;
(4)第三周期中,正负化合价之和为4的元素X为S元素.硫化氢与二氧化硫的反应方程式为:2H2S+SO2=3S↓+2H2O;
地壳中含量最多的金属的单质为Al,短周期元素形成的最强的碱为NaOH,二者反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2H2S+SO2=3S↓+2H2O;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)A与B反应的化学方程式为:CaC2+NH4HCO3=NH3↑+C2H2↑+CaCO3↓,
故答案为:CaC2+NH4HCO3=NH3↑+C2H2↑+CaCO3↓.
| 氧气 |
| 氧气 |
| 高温 |
| H2O |
(1)由上述分析可知,B为CaC2,其电子式为:
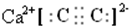 ,
,故答案为:
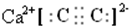 ;
;(2))①在A溶液中加入M,为NH4HCO3与HNO3反应生成硝酸铵、二氧化碳、水,反应离子方程式为:HCO3-+H+=H2O+CO2↑,
故答案为:HCO3-+H+=H2O+CO2↑;
②向A溶液中加入过量NaOH溶液,为NH4HCO3与NaOH反应生成氨气、碳酸钠、水,反应离子方程式为:NH4++HCO3-+2OH-=NH3↑+2H2O+CO32-;
故答案为:NH4++HCO3-+2OH-=NH3↑+2H2O+CO32-;
(3)M为硝酸,组成B的非金属元素的单质为碳,碳与硝酸反应的化学方程式为:C+4HNO3(浓)
| ||
故答案为:C+4HNO3(浓)
| ||
(4)第三周期中,正负化合价之和为4的元素X为S元素.硫化氢与二氧化硫的反应方程式为:2H2S+SO2=3S↓+2H2O;
地壳中含量最多的金属的单质为Al,短周期元素形成的最强的碱为NaOH,二者反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2H2S+SO2=3S↓+2H2O;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)A与B反应的化学方程式为:CaC2+NH4HCO3=NH3↑+C2H2↑+CaCO3↓,
故答案为:CaC2+NH4HCO3=NH3↑+C2H2↑+CaCO3↓.
点评:本题以无机框图题的形式考查N、Ca、C、S等元素单质及其化合物之间的相互转化关系和逻辑推理能力、化学用语的书写等,G为红棕色气体是推断突破口,结合顺推与逆推相结合推断,A、B的推断与反应是本题的难点,需要结合逆推法确定产物进行推理,根据转化关系进行推测验证,对学生的逻辑推理能力提出较高要求.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
 已知:A为酸式盐,B为某二价主族金属元素的化合物,其中B的化学式中共有36个电子,常温常压下C、D、F、G、I均呈气态,除G呈红棕色外其他气体均为无色.H在常温下是无色液体.等物质的量A、B与少量的H充分混合能恰好完全反应.图中反应条件(除高温外)均已略去.
已知:A为酸式盐,B为某二价主族金属元素的化合物,其中B的化学式中共有36个电子,常温常压下C、D、F、G、I均呈气态,除G呈红棕色外其他气体均为无色.H在常温下是无色液体.等物质的量A、B与少量的H充分混合能恰好完全反应.图中反应条件(除高温外)均已略去.


