题目内容
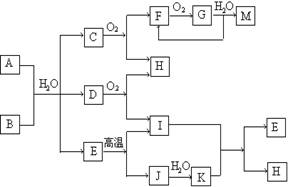
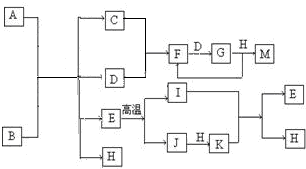 已知:A为酸式盐,B为某二价主族金属元素的化合物,其中B的化学式中共有36个电子,常温常压下C、D、F、G、I均呈气态,除G呈红棕色外其他气体均为无色.H在常温下是无色液体.等物质的量A、B与少量的H充分混合能恰好完全反应.图中反应条件(除高温外)均已略去.
已知:A为酸式盐,B为某二价主族金属元素的化合物,其中B的化学式中共有36个电子,常温常压下C、D、F、G、I均呈气态,除G呈红棕色外其他气体均为无色.H在常温下是无色液体.等物质的量A、B与少量的H充分混合能恰好完全反应.图中反应条件(除高温外)均已略去.(1)写出B的电子式


(2)写出下列反应的离子方程式:
①在A溶液中加入M
NH4++HCO3-+2OH-=NH3↑+2H2O+CO32-
NH4++HCO3-+2OH-=NH3↑+2H2O+CO32-
②向A溶液中加入过量NaOH溶液,并加热
NH4++HCO3-+2OH-=NH3↑+2H2O+CO32-
NH4++HCO3-+2OH-=NH3↑+2H2O+CO32-
(3)C还可在纯氧中安静燃烧,产物为H和一种单质,写出该反应的化学方程式:
4NH3+3O2=2N2+6H2O
4NH3+3O2=2N2+6H2O
(4)写出A与B反应的化学方程式
2CaO2+2NH4HCO3=2NH3↑+O2↑+2CaCO3↓+2H2O
2CaO2+2NH4HCO3=2NH3↑+O2↑+2CaCO3↓+2H2O
.分析:G呈红棕色,应为NO2,结合框图和题中已知条件,则D为O2、F为NO,M为HNO3,由此可推出,C为NH3.再根据H在常温下是无色液体,可知H为H2O;因D为O2,B应为过氧化物,根据电子数可推断出,B为CaO2;E高温分解,结合框图,可推出,E为CaCO3;再根据A为酸式盐,结合C、D、E、H,可知A为NH4HCO3,以此解答该题.
解答:解:G呈红棕色,应为NO2,结合框图和题中已知条件,则D为O2、F为NO,M为HNO3,由此可推出,C为NH3.再根据H在常温下是无色液体,可知H为H2O;因D为O2,B应为过氧化物,根据电子数可推断出,B为CaO2;E高温分解,结合框图,可推出,E为CaCO3;再根据A为酸式盐,结合C、D、E、H,可知A为NH4HCO3,则
(1)B为CaO2,电子式为 ,故答案为:
,故答案为: ;
;
(2)①A为NH4HCO3,M为HNO3,二者反应的实质为HCO3-+H+=H2O+CO2↑,故答案为:HCO3-+H+=H2O+CO2↑;
②A为NH4HCO3,加入过量NaOH溶液,并加热,凡是反应的离子方程式为NH4++HCO3-+2OH-=NH3↑+2H2O+CO32-,
故答案为:NH4++HCO3-+2OH-=NH3↑+2H2O+CO32-;
(3)C为NH3,在O2中燃烧生成N2和H2O,反应的化学方程式为4NH3+3O2=2N2+6H2O,
故答案为:4NH3+3O2=2N2+6H2O;
(4)A为NH4HCO3,B为CaO2,反应的实质是CaO2与水反应生成氢氧化钙和氧气,氢氧化钙和反应生成碳酸钙和氨气,二者反应的化学方程式为
2CaO2+2NH4HCO3=2NH3↑+O2↑+2CaCO3↓+2H2O,故答案为:2CaO2+2NH4HCO3=2NH3↑+O2↑+2CaCO3↓+2H2O.
(1)B为CaO2,电子式为
 ,故答案为:
,故答案为: ;
;(2)①A为NH4HCO3,M为HNO3,二者反应的实质为HCO3-+H+=H2O+CO2↑,故答案为:HCO3-+H+=H2O+CO2↑;
②A为NH4HCO3,加入过量NaOH溶液,并加热,凡是反应的离子方程式为NH4++HCO3-+2OH-=NH3↑+2H2O+CO32-,
故答案为:NH4++HCO3-+2OH-=NH3↑+2H2O+CO32-;
(3)C为NH3,在O2中燃烧生成N2和H2O,反应的化学方程式为4NH3+3O2=2N2+6H2O,
故答案为:4NH3+3O2=2N2+6H2O;
(4)A为NH4HCO3,B为CaO2,反应的实质是CaO2与水反应生成氢氧化钙和氧气,氢氧化钙和反应生成碳酸钙和氨气,二者反应的化学方程式为
2CaO2+2NH4HCO3=2NH3↑+O2↑+2CaCO3↓+2H2O,故答案为:2CaO2+2NH4HCO3=2NH3↑+O2↑+2CaCO3↓+2H2O.
点评:本题考查无机物的推断,题目难度较大,注意根据物质的特性作为推断的突破口,解答时注意把握化学方程式的书写,掌握物质的性质,判断反应原理是关键.

练习册系列答案
相关题目