题目内容
【题目】有人研究了340 K时N2O5的分解反应:2N2O5(g)===4NO2(g)+O2(g),得到不同物质在不同时刻的浓度,见下表。
t/min | 0 | 1 | 2 | 3 | 4 |
c(N2O5)/mol·L-1 | 0.160 | 0.114 | 0.080 | 0.056 | 0.040 |
c(O2)/mol·L-1 | 0 | 0.023 | 0.040 | 0.052 | 0.060 |
(1)图像能够非常直观地描述物理量的变化趋势。请你在下图中作出c(NO2)t图像。_________

(2)数据处理是化学实验过程中非常重要的一个环节。请计算3~4min时v(N2O5)=______________。
(3)各物质的化学反应速率之间的关系:________________。
(4)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。应该测定的实验数据是___________________________________。

(5)利用所学的知识,描述升温到800 K时N2O5的分解速率加快的原因____________。
【答案】 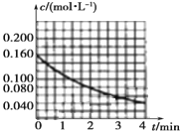 v(N2O5)=0.16/mol·L-1·min-1 反应速率比等于各物质的化学计量数之比 单位时间内收集到的气体的体积或收集相同体积气体时所需要的时间 升高温度活化分子百分数增多,有效碰撞次数增多,反应速率加快
v(N2O5)=0.16/mol·L-1·min-1 反应速率比等于各物质的化学计量数之比 单位时间内收集到的气体的体积或收集相同体积气体时所需要的时间 升高温度活化分子百分数增多,有效碰撞次数增多,反应速率加快
【解析】(1)依据题给数据在坐标系内描点作图,得到c(NO2)t图像为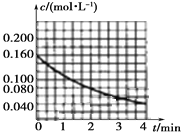 ,故答案为:
,故答案为: ;
;
(2)t4-t3:v(N2O5)= ![]() =0.016 molL-1min,故答案为:0.016 molL-1min;
=0.016 molL-1min,故答案为:0.016 molL-1min;
(3)在化学方程式中,各物质的化学反应速率之比等于各物质的化学计量数之比,故答案为:反应速率之比等于各物质的化学计量数之比;
(4)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置进行定量实验,根据实验要求需要测定一定时间产生气体的体积或测定产生一定体积的气体所需时间,故答案为:测定一定时间产生气体的体积或测定产生一定体积的气体所需时间;
(5)升高温度活化分子百分数增多,有效碰撞次数增多,反应速率加快,因此升温到800 K时N2O5的分解速率加快,故答案为:升高温度活化分子百分数增多,有效碰撞次数增多,反应速率加快。

