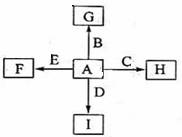
题目内容
(12分) A、B、C、D、E、F六种化合物。其中A、B、C、D、E均由短周期元素组成,焰色反应均呈黄色,B、C、E均由三种元素组成,B、C的组成元素相同,且C的摩尔质量比B大80g/mol请回答下列问题:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)下表为B与F实验的部分内容:
写出B与稀H2S04反应的离子方程式: ;
写出②中反应的化学方程式: 。
(3)现由6种粒子Mn2+、MnO4一、H十、H2 0、X2Y82一(C中含有的阴离子)、XY42一完成一个离子方程式,已知Mn2+为还原剂,得到1mol MnO4一需氧化剂的物质的量为 。
(4)化合物D和E可以相互转化: 若有D和E·XH20的混合物13.04g,加热到完全反应后,气体产物通过浓H2S04增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为 ,E·XH20的化学式为 。
若有D和E·XH20的混合物13.04g,加热到完全反应后,气体产物通过浓H2S04增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为 ,E·XH20的化学式为 。
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)下表为B与F实验的部分内容:
| 序号 | 主要实验步骤及实验现象 |
| ① | 在含有B的溶液中,加入稀H2S04,产生浅黄色浑浊和无色有刺激性气味的气体。 |
| ② | 20 ml沸水中滴加F的饱和溶液1~2ml,所得液体呈红褐色 |
| ③ | 将实验②得到的红褐色液体加热蒸发、灼烧,最终得到红棕色固体 |
写出②中反应的化学方程式: 。
(3)现由6种粒子Mn2+、MnO4一、H十、H2 0、X2Y82一(C中含有的阴离子)、XY42一完成一个离子方程式,已知Mn2+为还原剂,得到1mol MnO4一需氧化剂的物质的量为 。
(4)化合物D和E可以相互转化:
 若有D和E·XH20的混合物13.04g,加热到完全反应后,气体产物通过浓H2S04增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为 ,E·XH20的化学式为 。
若有D和E·XH20的混合物13.04g,加热到完全反应后,气体产物通过浓H2S04增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为 ,E·XH20的化学式为 。(1)AC (2) S2O32-+2H+=S↓+SO2↑+H2O FeCl3+3H2O Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
(3)2.5mol (4)8.4 g Na2C03·7H2O
 Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl(3)2.5mol (4)8.4 g Na2C03·7H2O
(1)固体化合物A为浅黄色粉末,则是过氧化钠。过氧化钠中含有离子键和非极性键。答案是AC。
(2)根据②③可知F是氯化铁溶液。根据①可知B是NaS2O3, B和硫酸反应的方程式为S2O32-+2H+=S↓+SO2↑+H2O,②属于氢氧化铁胶体的制备,方程式为FeCl3+3H2O Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。
(3)Mn2+被氧化生成MnO4-,化合价升高5个单位。氧化剂是X2Y82一,其还原产物是SO42-,1mol氧化剂得到2mol电子。所以根据电子的得失守恒可知。需要氧化剂的物质的量是2.5mol。
(4)根据转化可知D是碳酸氢钠。浓硫酸增加的质量就是水的质量,物质的量是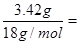 0.19mol。碱石灰增加的质量是CO2的质量,所以CO2的物质的量是0.05mol。因此D的物质的量是0.1mol,质量是8.4g。所以E·XH20的质量是4.64g,因此E·XH20中结晶水的物质的量是0.19mol-0.05mol=0.14mol,质量是2.52g。所以E·XH20中碳酸钠的质量是4.64g-2.52g=2.12g,其物质的量是0.02mol,即E·XH20的化学式为Na2C03·7H2O。
0.19mol。碱石灰增加的质量是CO2的质量,所以CO2的物质的量是0.05mol。因此D的物质的量是0.1mol,质量是8.4g。所以E·XH20的质量是4.64g,因此E·XH20中结晶水的物质的量是0.19mol-0.05mol=0.14mol,质量是2.52g。所以E·XH20中碳酸钠的质量是4.64g-2.52g=2.12g,其物质的量是0.02mol,即E·XH20的化学式为Na2C03·7H2O。
(2)根据②③可知F是氯化铁溶液。根据①可知B是NaS2O3, B和硫酸反应的方程式为S2O32-+2H+=S↓+SO2↑+H2O,②属于氢氧化铁胶体的制备,方程式为FeCl3+3H2O
 Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。(3)Mn2+被氧化生成MnO4-,化合价升高5个单位。氧化剂是X2Y82一,其还原产物是SO42-,1mol氧化剂得到2mol电子。所以根据电子的得失守恒可知。需要氧化剂的物质的量是2.5mol。
(4)根据转化可知D是碳酸氢钠。浓硫酸增加的质量就是水的质量,物质的量是
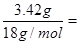 0.19mol。碱石灰增加的质量是CO2的质量,所以CO2的物质的量是0.05mol。因此D的物质的量是0.1mol,质量是8.4g。所以E·XH20的质量是4.64g,因此E·XH20中结晶水的物质的量是0.19mol-0.05mol=0.14mol,质量是2.52g。所以E·XH20中碳酸钠的质量是4.64g-2.52g=2.12g,其物质的量是0.02mol,即E·XH20的化学式为Na2C03·7H2O。
0.19mol。碱石灰增加的质量是CO2的质量,所以CO2的物质的量是0.05mol。因此D的物质的量是0.1mol,质量是8.4g。所以E·XH20的质量是4.64g,因此E·XH20中结晶水的物质的量是0.19mol-0.05mol=0.14mol,质量是2.52g。所以E·XH20中碳酸钠的质量是4.64g-2.52g=2.12g,其物质的量是0.02mol,即E·XH20的化学式为Na2C03·7H2O。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 B+H能放出大量的热,该反应曾应用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应:2E+I
B+H能放出大量的热,该反应曾应用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。