题目内容
下列叙述正确的是 ( )
| A.95℃纯水的pH<7,说明加热可导致水呈酸性 |
| B.pH=3的醋酸溶液,稀释10倍后pH=4 |
| C.0.2mol/L的盐酸与等体积水混合后pH=1 |
| D.常温下,pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 |
C
95℃纯水的pH<7,是因为温度升高,导致水的电离平衡正向移动,C(H+)大于25℃时的10-7 mol/L,则PH<7,故A错误;
pH=3的醋酸中,C(H+)=10-3 mol/L,稀释时将导致醋酸的电离平衡(CH3COOH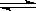 CH3COO-+ H+)正向移动,所以稀释10倍后,10-4<C(H+)<10-3,则4<PH<3,故B错误;
CH3COO-+ H+)正向移动,所以稀释10倍后,10-4<C(H+)<10-3,则4<PH<3,故B错误;
C(H+)=(0.2mol/L×V)/2V=0.1 mol/L,则pH=1,故C正确;
pH=3的醋酸中,C(H+)=10-3 mol/L, pH=11的氢氧化钠溶液中,C(OH-)=10-3 mol/L, 等体积混合后,表面上看起来恰好反应,但醋酸是弱酸,刚刚所求的C(H+)=10-3 mol/L这只是醋酸中自由移动的H+,实际上还有大部分的H+以CH3COOH分子的形式存在,即醋酸是过量的,则混合后pH应小于7,故D错误;
pH=3的醋酸中,C(H+)=10-3 mol/L,稀释时将导致醋酸的电离平衡(CH3COOH
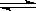 CH3COO-+ H+)正向移动,所以稀释10倍后,10-4<C(H+)<10-3,则4<PH<3,故B错误;
CH3COO-+ H+)正向移动,所以稀释10倍后,10-4<C(H+)<10-3,则4<PH<3,故B错误;C(H+)=(0.2mol/L×V)/2V=0.1 mol/L,则pH=1,故C正确;
pH=3的醋酸中,C(H+)=10-3 mol/L, pH=11的氢氧化钠溶液中,C(OH-)=10-3 mol/L, 等体积混合后,表面上看起来恰好反应,但醋酸是弱酸,刚刚所求的C(H+)=10-3 mol/L这只是醋酸中自由移动的H+,实际上还有大部分的H+以CH3COOH分子的形式存在,即醋酸是过量的,则混合后pH应小于7,故D错误;

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目