题目内容
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
Ⅰ. 已知部分弱酸的电离常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离常数(25℃) | Ka= 1.77×10-4 | Ka=4.3×l0-10 | Ka1=5.0×l0-7Ka2=5.6×l0-11 |
(1)0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3 -)(填“>”、“<”或“=”)。
(2)常温下,pH相同的三种溶液A.HCOONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
(3)室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是___________。
Ⅱ. 室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。

(4)d点所示的溶液中离子浓度由大到小的顺序依次为_______________。
(5)b点所示的溶液中c(NH3·H2O) - c(NH4+)=______(用溶液中的其它离子浓度表示)。
Ⅲ. 已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
(6)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中![]() =___________(保留三位有效数字)。
=___________(保留三位有效数字)。
【答案】< ABC HCOO-+H2O![]() HCOOH+OH- c(C1-)>c(NH4+)>c(H+)>c(OH-) )2 c(H+)-2c(OH-) 23.6
HCOOH+OH- c(C1-)>c(NH4+)>c(H+)>c(OH-) )2 c(H+)-2c(OH-) 23.6
【解析】
(1)酸的电离平衡常数越大,酸的酸性越强,其对应的酸根离子水解程度越小;
(2)常温下,酸的电离平衡常数越大,酸的酸性越强,其对应的酸根离子水解程度越小,
(3)室温下,一定浓度的![]() 溶液pH=9,甲酸钠是强碱弱酸盐,
溶液pH=9,甲酸钠是强碱弱酸盐,![]() 水解导致溶液呈碱性;
水解导致溶液呈碱性;
(4)d点酸碱恰好完全反应生成氯化铵,氯化铵水解导致溶液呈酸性,![]() ,结合电荷守恒得
,结合电荷守恒得![]() ,水解程度较小;
,水解程度较小;
(5)b点溶液为含等物质的量的氯化铵和一水合氨的混合溶液,根据电荷守恒和物料守恒得质子守恒;
(6)根据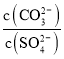 =
=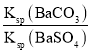 计算。
计算。
(1)酸的电离平衡常数越大,酸的酸性越强,其对应的酸根离子水解程度越小,根据表中数据知,酸的电离平衡常数:![]() ,则水解程度:
,则水解程度:![]() ,酸根离子水解程度越大,其水溶液中酸根离子浓度越小,所以存在
,酸根离子水解程度越大,其水溶液中酸根离子浓度越小,所以存在![]() ;
;
故答案为:<;
(2)常温下,酸的电离平衡常数越大,酸的酸性越强,其对应的酸根离子水解程度越小,浓度相同时水解程度:![]() ,故pH相同的
,故pH相同的![]() ,浓度由大到小的顺序是
,浓度由大到小的顺序是![]() ;
;
故答案为:ABC;
(3)室温下,一定浓度的![]() 溶液pH=9,甲酸钠是强碱弱酸盐,
溶液pH=9,甲酸钠是强碱弱酸盐,![]() 水解导致溶液呈碱性,水解离子方程式为:
水解导致溶液呈碱性,水解离子方程式为:![]() ;
;
故答案为:![]() ;
;
(4)d点酸碱恰好完全反应生成氯化铵,氯化铵水解导致溶液呈酸性,![]() ,结合电荷守恒得
,结合电荷守恒得![]() ,水解程度较小,d点所示的溶液中离子浓度由大到小的顺序
,水解程度较小,d点所示的溶液中离子浓度由大到小的顺序![]() ;
;
故答案为:![]() ;
;
(5)b点溶液为含等物质的量的氯化铵和一水合氨的混合溶液,故b点溶液中存在电荷守恒![]() ,存在物料守恒
,存在物料守恒![]() ,所以得
,所以得![]() ,则
,则![]() ,
,
故答案为:![]() ;
;
(6)向含有![]() 固体的溶液中滴加
固体的溶液中滴加![]() 溶液,当有
溶液,当有![]() 沉淀生成时,
沉淀生成时,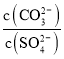 =
=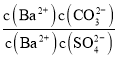 =
=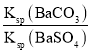 =
=![]() =23.6;
=23.6;
故答案为:23.6。

【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是

选项 | ① | ② | ③ | 实验结论 |
A | 浓氨水 | NaOH | 酚酞试液 | 碱性:NaOH>NH3·H2O |
B | 浓硫酸 | 蔗糖 | 品红溶液 | 浓硫酸具有脱水性、氧化性 |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐反应均可生成白色沉淀 |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
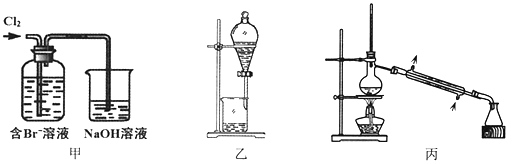
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2