��Ŀ����
��9�֣�������ѧ֪ʶ���������Ҫ��
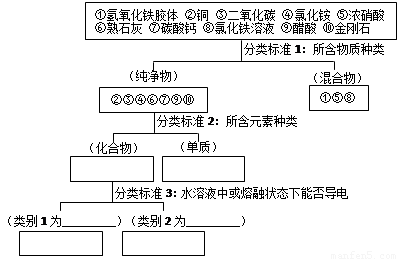
��1��������������� �����1���ܢ���� ��
����2������ ��
��2����ʵ�����Ʊ�������������ķ����ǣ���100 mL�ձ��м���50 mLˮ�����������ڣ� ��
����������������Ȼ�����Һ������Ϻ��ѽ������֣�����˵����ȷ����_________
A���������������н���ֱ������1 nm��100 nm֮��
B�����ߵı����������������������ж����ЧӦ
C���������������ɢ�����Ӳ�������Ĥ������ֽ
��9�֣�
��1����״���෨��1�֣� �ߢ���2�֣� �ǵ������2�֣�
��2�������ˮ�еμӼ��α����Ȼ�����Һ�������������Һ�ʺ��ɫ����ֹͣ������2�֣�
��AC��2�֣�
��������
�������������Գ������ʽ��з��ಢ�������ʡ��ǵ���ʡ�����ȸ���Ŀ��顣
��1�����������״���෨�ͽ�����෨���÷�������״���෨��ͭ ��������̼���Ȼ�李�����ʯ�ҡ�̼��ơ������ᡢ���ʯ�е�����ͭ�ͽ��ʯ���������в��ܵ�����Ƕ�����̼��������̼����ˮ��Ȼ���Ե��磬��ʵ�ʵ������̼�ᣬ������̼�������ܵ��磬���ڷǵ���ʡ�
��2��Fe(OH)3������Ʊ�������ע������⣺��ʵ������У�����ѡ���Ȼ���������Һ���������Ȼ���ϡ��Һ�������ˮ�еμ�FeCl3������Һ��������ֱ�Ӽ���FeCl3������Һ��������ˮ�еμ��Ȼ���������Һ������е��к��ɫ��Һ���־�ֹͣ���ȣ������˳�ʱ����ȡ������ɢϵ�ı��������Ƿ�ɢ�����ӵĴ�С����ɢϵ������(���Ƿ�������һ���ȶ�)�������������ġ���������Һ��������ƣ�һ���ö�������������Һ�ͽ��塣
���㣺�����˷��෨������ʡ��ǵ���ʼ���������ʼ�������Ʊ�
�������жϵ���ʵķ��������ǿ��������ֻҪ���ᡢ��Ρ����ֻ��ý���������(��MgO��Al2O3)��ˮ�����ǵ���ʣ�����֮��Ļ������������Ƿǵ���ʣ���ǽ���������ǽ����⻯��ƾ������ǵȴ��л����Ƿǵ���ʡ�ֻҪ����ס�����������ʵĸ����������������Ʊ�����������ʣ�������Ժܿ��������ڼ��⡣

��11�֣�������ѧ֪ʶ���������Ҫ��
��1��0.2 mol OH��������Ϊ �����к��� �����ӣ������ L HCl��������ˮ�����12 mol/L HCl��Һ500 mL��
��2���ҹ�������ʹ��ͭ����Ͻ��Ĺ���֮һ���ҹ��Ŵ��Ͷ����������������Ȼͭ�Ļ��������ʪ����ͭ������ʪ����������Դ�������绯ѧʷ�ϵ�һ����������������ӡ�����������أ����������Ϊͭ������Ϊ����ͭ��
�ڸ÷�Ӧ�б�������Ԫ���� ���������� ���÷�Ӧ�����ӷ���ʽΪ�� ��
��3�����й����ʵķ���ش���������⡣
������һƿA��B�Ļ��Һ����֪���ǵ��������±���
| ���� | �۵�/�� | �е�/�� | �ܶ�/g��cm��3 | �ܽ��� |
| A | ��11.5 | 198 | 1.11 | A��B���ܣ��Ҿ�������ˮ |
| B | 17.9 | 290 | 1.26 |
���ڷ�Һ©������һ���л��ܼ���ȡˮ��Һ���ij����ʱ�����÷ֲ�������֪����һ��Һ���ǡ�ˮ�㡱�������һ�ּ����жϷ�����
�� ��
������ѧ֪ʶ������������⣺
��1����ѧ��Ӧ����Ϊ�ɼ����Ѻ��¼����ɵĹ��̡��������γɣ����1 mol��ѧ��ʱ�ͷţ������գ�����������֪������ȼ�ղ���P4O6�ķ��ӽṹ��ͼ��ʾ�����ṩ���¼��ܣ�kJ�� mol-1���� P��P��198�� P��O��360�� O��O��498������(P4)ȼ�յ��Ȼ�ѧ����ʽΪ ��

��2����ѧ�������֮������ת������Fe��Cu��C(ʯī)��CuSO4��Һ��FeSO4��Һ��Fe2(SO4)3��Һ ��AgNO3��ҺΪԭ�ϣ�ͨ��ԭ��ط�Ӧʵ��2Fe3+ + Cu��2Fe2+ + Cu2+,�������ͼ����������ʹ֮�γɱպϻ�·������Ԫ�ط��ű����缫���׳��е��Һ�� ��Һ���ҳ��е��Һ�� ��Һ����Ҫ�ס��������е����Ԫ������ʼ�ձ��ֲ��䣩

��3��ij�жԴ������м�⣬���ָ�����Ҫ��Ⱦ��Ϊ�����������PM2.5��ֱ��С�ڵ���2.5��m���������������Ҫ��ԴΪȼú��������β���ȡ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣��ش��������⣺
�ٶ�PM2.5��������������ˮ�������Ƴɴ�������������ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
|
���� |
K+ |
Na+ |
NH4+ |
SO4���� |
NO3�� |
Cl�� |
|
Ũ��/ mol?L-1 |
4��10-6 |
6��10-6 |
2��10-5 |
4��10-5 |
3��10-5 |
2��10-5 |
���ݱ��������жϸ������������Ϊ ��������pHֵ=
����֪����������NO�ķ�ӦΪ��N2(g)+O2(g)  2NO(g)
2NO(g)  H��0
H��0
��1 mol��������0.8 molN2��0.2 molO2,1300��ʱ���ܱ������ڷ�Ӧ�ﵽƽ�⡣���NOΪ8 �� 10-4 mol.������¶��µ�ƽ�ⳣ��K= ___________�����������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��ԭ���� ��

