题目内容
(11分)根据所学知识,完成下列要求。
(1)0.2 mol OH-的质量为 ,其中含有 个电子;标况下 L HCl气体溶于水可配成12 mol/L HCl溶液500 mL。
(2)我国是最早使用铜及其合金的国家之一,我国古代劳动人民更最早利用天然铜的化合物进行湿法炼铜,这是湿法技术的起源,是世界化学史上的一项发明。西汉《淮南子·万毕术》记载:曾青得铁则化为铜,曾青为硫酸铜。
在该反应中被氧化的元素是 ,氧化剂是 ;该反应的离子方程式为: 。
(3)就有关物质的分离回答下面的问题。
①现有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
②在分液漏斗中用一种有机溶剂萃取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。
答: 。
(11分)
(1)3.4 g(1分) 1.204×1024(1分) 134.4(2分)
(2)Fe(1分) CuSO4(1分) Fe+Cu2+═ Fe2++Cu(2分)
(3)①分馏(蒸馏)(1分)
②向漏斗中加入少量水,体积增大的液层是水层(2分)
解析试题分析:
(1)根据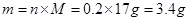 ,
,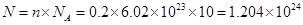 ,
,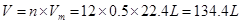
(2)根据Fe+Cu2+═ Fe2++Cu,依据被氧化的元素化合价升高,可知是Fe;氧化剂是参加反应的物质中元素化合价降低可知是硫酸铜或铜离子;
(3)A和B互溶,且均易溶于水,不能用分液法或过滤等方法,又两者沸点相差较大,可以采用蒸馏法或分馏法;因为有机溶剂与水不溶,可以向漏斗中加入少量水,体积增大的液层是水层。
考点:物质的量的计算、氧化还原反应概念的判断、物质检验与分离的方法。
点评:考查点多但是立足基础,属于较基础简单题。

根据所学知识,完成下列问题:
(1)化学反应可视为旧键断裂和新键生成的过程。键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和其燃烧产物P4O6的分子结构如图所示,现提供以下键能(kJ· mol-1): P-P:198, P-O:360, O-O:498,白磷(P4)燃烧的热化学方程式为 。

(2)化学能与电能之间可以相互转化,以Fe、Cu、C(石墨)、CuSO4溶液、FeSO4溶液、Fe2(SO4)3溶液 、AgNO3溶液为原料,通过原电池反应实现2Fe3+ + Cu=2Fe2+ + Cu2+,请你把下图补充完整,使之形成闭合回路,并用元素符号标明电极。甲池中电解液是 溶液;乙池中电解液是 溶液。(要求:甲、乙两池中电解质元素种类始终保持不变)

(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
①对PM2.5空气样本用蒸馏水处理,制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
|
离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
|
浓度/ mol?L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断该试样的酸碱性为 ,试样的pH值=
②已知气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g)
2NO(g)  H>0
H>0
若1 mol空气含有0.8 molN2和0.2 molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8 × 10-4 mol.计算该温度下的平衡常数K= ___________;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。

