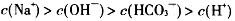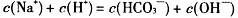题目内容
水的电离方程为H2O H++OH—,在不同的温度下,其平衡常数K(25℃)=1×10-14, K(35℃)=2.1×10-14,则下列叙述正确的是:
H++OH—,在不同的温度下,其平衡常数K(25℃)=1×10-14, K(35℃)=2.1×10-14,则下列叙述正确的是:
 H++OH—,在不同的温度下,其平衡常数K(25℃)=1×10-14, K(35℃)=2.1×10-14,则下列叙述正确的是:
H++OH—,在不同的温度下,其平衡常数K(25℃)=1×10-14, K(35℃)=2.1×10-14,则下列叙述正确的是:| A.c(H+)随着温度的升高而降低 | B.在35℃时,C(H+)> C(OH—) |
| C.在25℃时,水的电离常数为1.8×10-16 | D.水的电离是放热的 |
B
试题分析:温度越高,电离平衡常数越大,说明水的电离的过程是吸热的。A项:升高温度,水的电离平衡正向移动,c(H+)增大,故错;C项:体积没给,无法计算,故错;D项:水的电离是吸热的,故错。故选B。
点评:本题考查的是影响水的电离平衡的因素的知识,难度中。学生平时多注意基础知识的学习。

练习册系列答案
相关题目