题目内容
在T℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T℃),测得混合溶液的部分pH如下表所示:
| 序号 | NaOH溶液体积 | 盐酸体积 | 溶液pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为( )
A.1 B.4 C.5 D.6
B
解析

练习册系列答案
相关题目
下列叙述正确的是
| A.浓度均为0.1 mol·L-1的下列溶液,pH由大到小的排列顺序为:NaOH>Na2CO3>(NH4)2SO4>NaHSO4 |
| B.为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH >7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.常温下,将pH=3的醋酸溶液稀释到原体积的10倍,稀释后溶液的pH=4 |
| D.常温下KSP(AgCl)=1.5×10-4,此时将足量氯化银固体分别投入相同体积的①蒸馏水②0.1mol/L盐酸③0.1 mol/L氯化镁溶液④0.1 mol/L硝酸银溶液中,则溶液中Ag+浓度:①>④=②>③ |
常温下,对下列电解质溶液的有关说法正确的是( )
| A.相同浓度和体积的强碱和强酸溶液混合后,溶液的pH一定等于7 |
| B.在NaHCO3溶液中,c(CO32—)>c(HCO3—) |
| C.在有AgCl沉淀的溶液中加入NaCl固体,c(Ag+)减小 |
| D.将pH相等的CH3COONa和Na2CO3溶液稀释相同倍数,CH3COONa溶液的pH较大 |
25 ℃时,水中存在电离平衡:H2O H++OH-,下列关于水的说法,不正确的是( )
H++OH-,下列关于水的说法,不正确的是( )
| A.水的电离是吸热过程 |
| B.向水中加入少量稀硫酸,c(H+)增大,KW不变 |
| C.含H+的溶液显酸性,含OH-的溶液显碱性 |
| D.水是极弱的电解质,在50 ℃时水的pH小于7 |
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10。下列说法不正确的是( )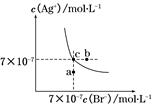
| A.在t℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |
下表是三种难溶金属硫化物的溶度积常数(25 ℃)。
| 化学式 | FeS | CuS | MnS |
| 溶度积 | 6.3×10-18 | 1.3×10-36 | 2.5×10-13 |
下列有关说法中正确的是( )
A.25 ℃时,CuS的溶解度大于MnS的溶解度
B.25 ℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol/L
C.因为H2SO4是强酸,所以反应CuSO4+H2S
 CuS↓+H2SO4不能发生
CuS↓+H2SO4不能发生D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
| A.在任何溶液中,c(Ca2+)、c(SO42-)均相等 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L |
| C.a点对应的Ksp等于c点对应的Ksp |
| D.d点溶液通过蒸发可以变到c点 |
已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH: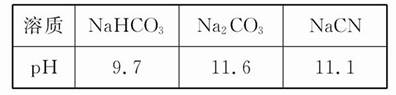
下列说法中正确的是( )
| A.阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3 |
| B.相同条件下的酸性:H2CO3<HCN |
| C.三种溶液中均存在电离平衡和水解平衡 |
D.升高Na2CO3溶液的温度,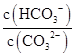 减小 减小 |
常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 HCl溶液,滴定曲线如图所示。下列说法不正确的是 ( )。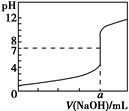
| A.若将盐酸换成同浓度的醋酸溶液,则滴定到pH=7时,a>20.00 |
| B.该滴定也可以用甲基橙作指示剂 |
| C.若用酚酞作指示剂,当滴定到溶液由无色变为红色且半分钟内不褪色时停止滴定 |
| D.滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-) |