题目内容
下列叙述正确的是
| A.浓度均为0.1 mol·L-1的下列溶液,pH由大到小的排列顺序为:NaOH>Na2CO3>(NH4)2SO4>NaHSO4 |
| B.为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH >7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.常温下,将pH=3的醋酸溶液稀释到原体积的10倍,稀释后溶液的pH=4 |
| D.常温下KSP(AgCl)=1.5×10-4,此时将足量氯化银固体分别投入相同体积的①蒸馏水②0.1mol/L盐酸③0.1 mol/L氯化镁溶液④0.1 mol/L硝酸银溶液中,则溶液中Ag+浓度:①>④=②>③ |
A
解析试题分析:A、浓度均为0.1 mol·L-1的4种溶液中,NaOH溶液的碱性最强,pH最大,NaHSO4溶液的酸性最强,pH最小,Na2CO3水解使溶液显碱性,(NH4)2SO4水解使溶液显酸性,所以pH由大到小的排列顺序为:NaOH>Na2CO3>(NH4)2SO4>NaHSO4,正确;B、若H2A是强酸,则NaHA溶液的pH<7, 若H2A是弱酸,则NaHA溶液的pH不确定,须看HA-的水解程度与电离程度的大小比较,所以pH<7不能判断H2A是强酸,错误;C、醋酸为弱酸,稀释会促进醋酸的电离,所以体积扩大10倍,c(H+)降低不到原来的1/10,pH增加不到1,错误;D、KSP(AgCl)=c(Cl-)c(Ag+),①中c2(Ag+)=1.5×10-4,②中c(Cl-)=0.1mol/L,则c(Ag+)=1.5×10-4/0.1 =1.5×10-3 mol/L,③中c(Cl-)="0.2," c(Ag+)=1.5×10-4/0.2 =7.5×10-4 mol/L, ④中c(Ag+)="0.1" mol/L,所以溶液中Ag+浓度的大小顺序为④>①>②>③,错误,答案选A。
考点:考查同浓度的不同溶液的离子的比较、酸的强弱的判断、溶液稀释后pH的变化、溶度积的计算

下列说法正确的是
| A.相同物质的量浓度的下列溶液:①NH4Al(SO4)2、②NH4C1、③CH3COONH4、④NH3·H2O,c(NH4+)由大到小的顺序是:①>②>③>④ |
| B.某溶液中由水电离出的c( H+)=1×l0-amol/L,若a>7时,则该溶液的pH一定为14-a |
| C.常温下,向AgCl悬浊液中加入少量NaC1固体后振荡,c(Cl-)增大,Ksp(AgCl)增大 |
| D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-) +c(HR-)=c(Na+) |
今有两种盐的稀溶液,分别是a mol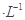 NaX溶液和b mol
NaX溶液和b mol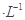 NaY溶液,下列说法不正确的是( )。
NaY溶液,下列说法不正确的是( )。
| A.若a=b,pH(NaX)>pH (NaY),则相同浓度时,酸性HX>HY |
| B.若a=b,并测得c(X-)="c" (Y-)+c(HY);则相同浓度时,酸性HX>HY |
| C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时, 酸性HX<HY |
D.若两溶液等体积混合,测得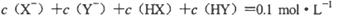 |
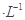
一定温度下,水存在H2O H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是( )
H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是( )
| A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 |
| B.将水加热,Kw增大,pH减小 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.向水中加入少量固体硫酸钠,c(H+)=10-7 mol·L-1,Kw不变 |
下列叙述正确的是( )
A.浓度均为0.1 mol·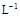 的CH3COOH和CH3COONa溶液等体积混合所得的溶液中: 的CH3COOH和CH3COONa溶液等体积混合所得的溶液中:c(CH3COOH)+c(CH3COO-)="0.2" mol· 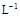 |
B.0.1 mol·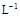 NaHCO3溶液中:c(Na+)=c(HC NaHCO3溶液中:c(Na+)=c(HC )+c(H2CO3)+2c(C )+c(H2CO3)+2c(C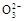 ) ) |
C.0.2 mol·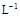 HCl溶液与等体积的0.1 mol· HCl溶液与等体积的0.1 mol·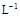 NaOH溶液混合后,溶液的pH=1 NaOH溶液混合后,溶液的pH=1 |
D.0.1 mol·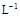 氨水中滴入0.1 mol· 氨水中滴入0.1 mol·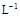 盐酸至溶液呈中性时,混合溶液中:c(N 盐酸至溶液呈中性时,混合溶液中:c(N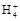 )=c(Cl-) )=c(Cl-) |
针对0.1 mol·L-1的醋酸溶液,下列分析判断正确的是( )
| A.升高温度,溶液的pH会增大 |
| B.加入少量固体NaOH,溶液中c(CH3COO-)+c(OH-)>c(Na+)+c(H+) |
| C.加入少量0.2 mol·L-1的硫酸溶液,水电离产生的c(H+)减小 |
| D.与0.1 mol·L-1的NaOH溶液等体积混合后,溶液中c(CH3COO-)=c(Na+) |
0.1mol·L-1HF溶液的pH=2,则该溶液中有关浓度关系式不正确的是( )
| A.c(H+)>c(F-) | B.c(H+)>c(HF) |
| C.c(OH-)<c(HF) | D.c(HF)>c(F-) |
在T℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T℃),测得混合溶液的部分pH如下表所示:
| 序号 | NaOH溶液体积 | 盐酸体积 | 溶液pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为( )
A.1 B.4 C.5 D.6
25 ℃时,在等体积的①pH=0的硫酸溶液、②0.05 mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
| A.1∶10∶1010∶109 | B.1∶5∶5×109∶5×108 |
| C.1∶20∶1010∶109 | D.1∶10∶104∶109 |