题目内容
【题目】下列离子方程式书写正确的是
A. 向稀盐酸中加铁粉:2Fe+6H+═2Fe3++3H2↑
B. 盐酸与硝酸银溶液反应:Cl﹣+Ag+═AgCl↓
C. 氢氧化钡溶液与稀硫酸反应:Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O
D. 碳酸钙溶于稀盐酸中:CO32﹣+2H+═CO2↑+H2O
【答案】B
【解析】A. 铁粉与稀盐酸反应生成氯化亚铁和氢气,A错误;B. 盐酸与硝酸银溶液反应:Cl﹣+Ag+═AgCl↓,B正确;C. 氢氧化钡溶液与稀硫酸反应:Ba2++2OH﹣+2H++SO42﹣═BaSO4↓+2H2O,C错误;D. 碳酸钙溶于稀盐酸,因碳酸钙难溶,则碳酸钙应写化学式(不拆),D错误。答案选B。

【题目】某化学小组以苯甲酸和异丙醇为原料,制取苯甲酸异丙酯(![]() ),已知有关物质的沸点如表:
),已知有关物质的沸点如表:
物质 | 异丙醇 | 苯甲酸 | 苯甲酸异丙酯 |
沸点/℃ | 82.4 | 249 | 218 |
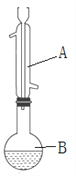
I合成苯甲酸异丙酯粗产品:
在如图圆底烧瓶中加入12.2 g苯甲酸和30 mL异丙醇(密度约为0.79 g·cm-3),再小心加入3mL浓硫酸,混匀后,投入几块碎瓷片,小心加热30分钟,使反应完全,得苯甲酸异丙酯粗产品。
(1)仪器A的名称是_______;加入碎瓷片的目的是__________。
(2)异丙醇的系统命名法的名称为:___________________。
(3)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式__________。
II粗产品的精制:
操作①中用到的一种重要仪器是_______________;操作②的名称是____________。

(5)通过计算,苯甲酸甲酯的产率为____________________________
(6)该实验中不能用于提高苯甲酸甲酯的产率的措施是___________
A.苯甲酸的质量由12.2g增加至24.4g
B.30ml的异丙醇增加至35mL