题目内容
2.下列中学常见实验的现象或表述正确的是( )| A. | 过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管中,滴加KSCN溶液,溶液显血红色 | |
| B. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| C. | 检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可 | |
| D. | FeO投入稀H2SO4和稀HNO3中均得到浅绿色溶液 |
分析 A.过量的铁投入到一定量的稀硝酸中,铁元素最终被氧化为+2价;
B.氢氧化亚铁很容易被空气中的氧气氧化为氢氧化铁;
C.氧化铁溶于盐酸,反应的氯化铁溶液,滴加KSCN溶液变红色;
D.硝酸有强氧化性.
解答 解:A.过量的铁投入到一定量的稀硝酸中,铁先被硝酸氧化为三价铁,铁能和三价铁反应生成亚铁离子,铁元素最终被氧化为+2价,滴加KSCN溶液,溶液不会显红色,故A错误;
B.向硫酸亚铁溶液中滴加氢氧化钠溶液发生复分解反应生成氢氧化亚铁白色沉淀,搅拌后,氢氧化亚铁很容易被空气中的氧气氧化为氢氧化铁,得不到白色沉淀物质,故B错误;
C.氧化铁和盐酸反应生成氯化铁溶液和水,三价铁遇KSCN溶液,会变红色,故C正确;
D.硝酸有强氧化性,能将二价铁离子氧化为三价铁离子,变为棕黄色,故D错误.
故选C.
点评 本题考查较为综合,涉及物质的制备、检验等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
12.某种溶液只含下表离子中的几种(不考虑水的电离与离子水解),且各种离子的物质的量浓度均为0.1mol•L-1.
某同学进行了如下实验(必要时可加热):
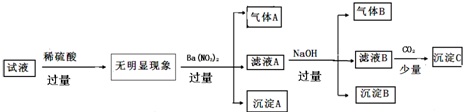
下列说法正确的是( )
| 阳离子 | K+ NH4+ Fe2+ Mg2+ Al3+ Cu2+ |
| 阴离子 | OH- Cl- AlO2- CO32- SO42- SiO32- |

下列说法正确的是( )
| A. | 原溶液中只含有 NH4+、Fe2+、Cl-、SO42- | |
| B. | 由沉淀A推断原溶液中一定含有SO42- | |
| C. | 滤液A中可能含有 K+、Al3+、Cl- | |
| D. | 沉淀B中一定含有Mg(OH)2 |
13.下列溶液中的Cl-的物质的量浓度与100mL 1mol•L-1AlCl3溶液中Cl-的物质的量浓度相等的是( )
| A. | 50mL 3 mol•L-1的KCl溶液 | B. | 150mL 1 mol•L-1的FeCl2溶液 | ||
| C. | 150mL 1 mol•L-1的MgCl2溶液 | D. | 300mL 1 mol•L-1的NaCl溶液 |
10.下列离子方程式书写正确的是( )
| A. | 氯气通入氯化亚铁溶液中:Cl2+Fe2+=2Cl-+Fe3+ | |
| B. | 碳酸钠溶于醋酸溶液中:CO32-+2 H+=H2O+CO2↑ | |
| C. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| D. | 硫酸与氢氧化钡溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
17.下列有关物质的性质或应用正确的是( )
| A. | 实验室常用铝盐溶液与氢氧化钠溶液制备Al(OH)3沉淀 | |
| B. | 浓硫酸能干燥SO2、NO2等气体,说明浓硫酸具有吸水性 | |
| C. | SO2 具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 | |
| D. | 30%的H2O2溶液中加入MnO2可制得O2,MnO2做氧化剂 |
7.下列各组物质中,互为同系物的是( )
| A. | 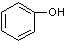 与 与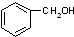 | B. |  与 与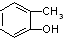 | C. |  与 与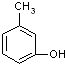 | D. | 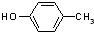 与 与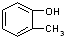 |
11.2006年1月,我国研制出能在超低温度下工作的镍氢电池.镍氢电池的反应式是:H2+2NiO(OH)$?_{充电}^{放电}$2Ni(OH)2,根据此反应判断下列叙述中正确的是( )
| A. | 电池放电时,电池负极周围溶液的pH不断增大 | |
| B. | 电池充电时,镍元素被氧化 | |
| C. | 电池充电时,镍元素被还原 | |
| D. | 电池放电时,H2是正极 |
12.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 常温常压下,33.6L氯气与27g铝充分反应,生成1molAlCl3 | |
| B. | 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 | |
| C. | 通常状况下,2.24LNO2和N2O4的混合气体中氮原子和氧原子数比为1:2 | |
| D. | 1L 1mol/L的Na2CO3溶液中所含阴离子数等于NA个 |
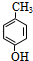 .
.
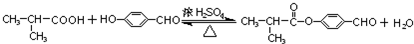
 .
.