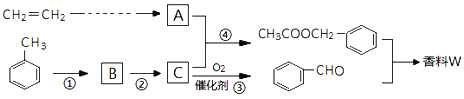
题目内容
【题目】A、B、C、D 均为短周期主族元素,且原子序数一次递增。A 是地壳中含量最多的元素, B 是短周期中金属性最强的元素,C 与 D 位置相邻,D 是同周期元素中原子半径最小的元素。完成下列填空:
(1)A 在周期表中的位置为第____周期______族,A 原子的最外层电子排布式为____,A 原子核外共有____个不同运动状态的电子。
(2)B、C、D 三种元素形成简单离子其半径大小的____________。(用个离子符号表示)
(3) A、B 形成化合物的电子式____;这些化合物中所含的化学键有____
(4)非金属性的强弱:C______D(填“强于”、“弱于”、“无法比较”),试从原子结构的角度解释其原因。_____请用一个方程式证明 A 与 C 的非金属性的强弱____。
【答案】二 ⅥA 2s22p4 8 S2->Cl- >Na+ ![]() 、
、![]() 离子键、共价键 弱于 非金属性也就是得电子的能力 S的原子序数是16 而Cl是17 所以Cl的原子半径小于S原子,Cl原子对电子的引力较大 所以捕获电子的能力也大 由反应2H2S+O2(不足)=2H2O+2S↓可知,O2是氧化剂,S是氧化产物,O2的氧化性大于S,非金属性越强,氧化性越强,说明S的非金属性小于O
离子键、共价键 弱于 非金属性也就是得电子的能力 S的原子序数是16 而Cl是17 所以Cl的原子半径小于S原子,Cl原子对电子的引力较大 所以捕获电子的能力也大 由反应2H2S+O2(不足)=2H2O+2S↓可知,O2是氧化剂,S是氧化产物,O2的氧化性大于S,非金属性越强,氧化性越强,说明S的非金属性小于O
【解析】
A、B、C、D 均为短周期主族元素,且原子序数一次递增。A是地壳中含量最多的元素,则A为氧元素; B 是短周期中金属性最强的元素,则B为钠元素;C 与 D 位置相邻,D 是同周期元素中原子半径最小的元素,则D为氯元素,C为硫元素;A、B、C、D分别为:O、Na、S、Cl 。
(1)A为氧元素,在周期表中的位置为第二周期ⅥA族,氧原子的最外层电子排布式为2s22p4,氧原子核外共有8个电子,则有8个不同运动状态的电子。
答案为:二;ⅥA;2s22p4;8;
(2) Na、S、Cl 三种元素形成简单离子分别为:Na+、S2-、Cl-,S2-、Cl-分别为三个电子层,Na+为两个电子层,Na+半径最小,电子层结构相同的粒子,核电荷数越大,半径越小,故S2-半径大于Cl-半径,半径大小的顺序为:S2->Cl- >Na+。
答案为:S2->Cl- >Na+;
(3) O和Na形成化合物有Na2O和Na2O2,电子式分别为![]() 、
、![]() ;这些化合物中所含的化学键有离子键、共价键;
;这些化合物中所含的化学键有离子键、共价键;
答案为:![]() 、
、![]() ;离子键、共价键;
;离子键、共价键;
(4) S和Cl为同周期元素,同周期元素从左至右,非金属性依次增强,则非金属性的强弱:S弱于Cl;从原子结构的角度非金属性也就是得电子的能力 S的原子序数是16 而Cl是17 所以Cl的原子半径小于S原子,Cl原子对电子的引力较大 所以捕获电子的能力也大;由反应2H2S+O2(不足)![]() 2H2O+2S↓可知,O2是氧化剂,S是氧化产物,O2的氧化性大于S,非金属性越强,氧化性越强,说明S的非金属性小于O;
2H2O+2S↓可知,O2是氧化剂,S是氧化产物,O2的氧化性大于S,非金属性越强,氧化性越强,说明S的非金属性小于O;
答案为:弱于;非金属性也就是得电子的能力 S的原子序数是16 而Cl是17 所以Cl的原子半径小于S原子,Cl原子对电子的引力较大 所以捕获电子的能力也大;由反应2H2S+O2(不足)=2H2O+2S↓可知,O2是氧化剂,S是氧化产物,O2的氧化性大于S,非金属性越强,氧化性越强,说明S的非金属性小于O。

【题目】温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. 反应0~4 min的平均速率υ(Z)=0.25 mol/(Lmin)
B. T1时,反应的平衡常数K1=1.2
C. 其他条件不变,9 min后,向容器中再充入1.6 molX,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大
D. 其他条件不变,降温到T2达到平衡时,平衡常数K2=4,则此反应的△H<0