题目内容
【题目】计算题:现有0.270g质量分数为10%的CuCl2溶液,计算:
(1)溶液中CuCl2的物质的量;
(2)溶液中Cu2+和Cl﹣的物质的量.
【答案】
(1)解:270g质量分数为10%的CuCl2溶液中m(CuCl2)=270g×10%=27g,所以n(CuCl2)= ![]() =0.2mol,
=0.2mol,
答:CuCl2的物质的量0.2mol
(2)解:n(Cu2+)=n(CuCl2)=0.2mol,n(Cl﹣)=2n(CuCl2)=0.2mol×2=0.4mol,
答:溶液中Cu2+和Cl﹣物质的量分别为0.2mol、0.4mol
【解析】(1)根据m(溶质)=m(溶液)×ω(溶质)计算出溶液中CuCl2的质量,再根据n= ![]() 计算出CuCl2的物质的量;(2)溶液中n(Cu2+)=n(CuCl2),n(Cl﹣)=2n(CuCl2).
计算出CuCl2的物质的量;(2)溶液中n(Cu2+)=n(CuCl2),n(Cl﹣)=2n(CuCl2).

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案【题目】下图是某工业生产过程。

溶解度表:
温度℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
氯化铵 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 55.2 | 65.6 | 71.3 | 77.3 |
硫酸铵 | 70.6 | 73 | 75.4 | 78 | 81 | 88 | 95 | 98 | 103 |
硫酸钾 | 7.4 | 9.3 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 22.9 | 24.1 |
氯化钾 | 28 | 31.2 | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 53.9 | 56.3 |
(1)本工业生产过程的目标产品是____________________________________。(写化学式)
(2)过滤Ⅰ操作所得固体中,除CaCO3外还有一种物质,该固体的用途有_________(试举一例)。
(3)根据溶解度表转化Ⅱ适宜的温度是________
A、0~10℃ B、20~30℃ C、40~60℃ D、90~100℃
过滤Ⅱ操作所得滤渣是__________。
(4)我国著名的化学家也利用了转化Ⅱ的反应原理制备了一种重要的碱,该制备的化学反应方程式为:___________________________________________________
(5)氯化钙结晶水合物(CaCl2·6H2O)进行脱水处理可制得常用的干燥剂,根据下图选择最佳脱水的方法是__________

A、氯化氢气流中加热到174℃ B、直接加热至174℃
C、直接加热至260℃ D、氯化氢气流中加热到260℃
(6)上述工业流程实现了绿色化学的理念,其中__________________(填化学式)实现了循环利用,副产品_________________________(填化学式)可转化为原料,整个流程基本实现了污染物零排放。
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
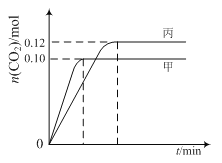
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)>v(逆)
D. T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%