题目内容
A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大。其中,元素M的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍,E的简单离子在同周期元素的简单离子中半径最小,D、G同主族;B与D形成的化合物有多种,其中一种是红棕色气体。
(1)M的基态原子价层电子排布式为_____,元素B、D、G的第一电离能由大到时小的顺序是_____ (用元素符号表示)。
(2)用价层电子对互斥理论预测,GD32-的立体构型是_____ (用文字表述)
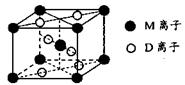
(3)M与D形成的一种橙红色晶体晶胞结构如图所示,其化学式为_____ (用元素符号表示)。
(4)已知化合物EB结构与单晶硅相似,该物质可由E 的氯化物与NaB3在高温下反应制得,且生成单质B2,该反应化学方程式为_____,若有8.4gB2生成,则转移电子数为_____。
(1)M的基态原子价层电子排布式为_____,元素B、D、G的第一电离能由大到时小的顺序是_____ (用元素符号表示)。
(2)用价层电子对互斥理论预测,GD32-的立体构型是_____ (用文字表述)
(3)M与D形成的一种橙红色晶体晶胞结构如图所示,其化学式为_____ (用元素符号表示)。

(4)已知化合物EB结构与单晶硅相似,该物质可由E 的氯化物与NaB3在高温下反应制得,且生成单质B2,该反应化学方程式为_____,若有8.4gB2生成,则转移电子数为_____。
(14分)
(1)3d24s2(2分) N>O>S(2分)
(2)三角锥形(2分)
(3)TiO2(3分)
(4)AlCl3+3NaN3= 3NaCl+AlN+4N2↑(3分) 1.204×1023或0.2NA(2分)
(1)3d24s2(2分) N>O>S(2分)
(2)三角锥形(2分)
(3)TiO2(3分)
(4)AlCl3+3NaN3= 3NaCl+AlN+4N2↑(3分) 1.204×1023或0.2NA(2分)
试题分析:A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大。其中元素M的基态3d轨道上有2个电子,价层电子排布式3d24s2,为钪元素;A的基态原子L层电子数是K层电子数的2倍,元素A为碳元素,E的简单离子在同周期元素的简单离子中半径最小,元素E为铝;B与D形成的化合物有多种,其中一种是红棕色气体,很显然元素B为氮元素,D为氧元素。D、G同主族,G为硫元素;

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

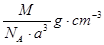
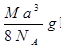
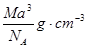
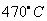 、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是
、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是