题目内容
硒是一种非金属,可以用作光敏材料、电解锰行业催化剂。
(l)Se是元素周期表中第34号元素,其基态原子的核外电子排布式为 。
(2)根据价层电子对互斥理论,可以推知SeO3的分子空间构型为 ,其中Se原子采用的轨道杂化形式为 。
(3)CSe2与CO2结构相似,CSe2分子内σ键与π键个数之比为 。CSe2首次是由H2Se与CCl4反应后制取的,CSe2分子内的Se—C—Se键角 (填“大于”,“等于”或“小于”)H2Se分子内的H—Se—H键角。
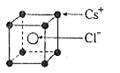
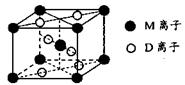
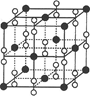
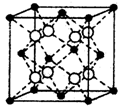
(4)硒化铷晶体属于反萤石型结构,晶胞结构如图所示。每个晶胞中包含 个Rb2Se单元,其中Se2-周围与它距离最近且相等的Rb+的离子数目为 。
(l)Se是元素周期表中第34号元素,其基态原子的核外电子排布式为 。
(2)根据价层电子对互斥理论,可以推知SeO3的分子空间构型为 ,其中Se原子采用的轨道杂化形式为 。
(3)CSe2与CO2结构相似,CSe2分子内σ键与π键个数之比为 。CSe2首次是由H2Se与CCl4反应后制取的,CSe2分子内的Se—C—Se键角 (填“大于”,“等于”或“小于”)H2Se分子内的H—Se—H键角。
(4)硒化铷晶体属于反萤石型结构,晶胞结构如图所示。每个晶胞中包含 个Rb2Se单元,其中Se2-周围与它距离最近且相等的Rb+的离子数目为 。

(8分)(1)1s22s22p63s23p63d104s24p4(2分)
(2)平面三角形;sp2(2分)
(3)1:1;大于(2分)
(4)4;8(2分)
(2)平面三角形;sp2(2分)
(3)1:1;大于(2分)
(4)4;8(2分)
试题分析:(l)硒是34号元素,基态原子核外有34个电子,所以根据构造原理可知,其基态原子核外电子排布式为1s22s22p63s23p63d104s24p4。
(2)根据价层电子对互斥理论可知,SeO3的分子中中心原子含有的孤对电子对数=(6-3×2)÷2=0。这说明分子中含有3个价层电子对,且没有孤电子对,所以其空间构型是平面三角形,采用sp2杂化。
(3)二氧化碳分子中含有2个碳氧双键,单键都是σ键,双键是由1个σ键与1个π键构成的,所以CO2分子内σ键与π键个数之比为2:2=1:1。CSe2与CO2结构相似,所以CSe2分子内σ键与π键个数之比也是1:1。二氧化碳是直线型分子,H2Se分子与水分子的空间构型相似,剩余v型分子,所以CSe2分子内的Se-C-Se键角大于H2Se分子内的H-Se-H键角。
(4)根据晶胞的结构可知,白色球都在晶胞内部,所以该晶胞中含有白色球个数=8,黑色球个数=8×
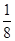 +6×
+6×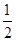 =4,所以每个晶胞中包含4个Rb2Se单元。由于1个面被8个面共用,根据晶胞结构可知,最上面面心上的Se2-距离最近且相等的Rb+的离子数目是8个。
=4,所以每个晶胞中包含4个Rb2Se单元。由于1个面被8个面共用,根据晶胞结构可知,最上面面心上的Se2-距离最近且相等的Rb+的离子数目是8个。
练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目

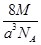 g·cm-3
g·cm-3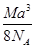 g·cm-3
g·cm-3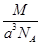 g·cm-3
g·cm-3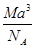 g·cm-3
g·cm-3