题目内容
【题目】草酸![]() 是一种重要的化工原料。某学习小组为探究草酸的性质,查阅了有关资料,草酸的部分性质如下表:
是一种重要的化工原料。某学习小组为探究草酸的性质,查阅了有关资料,草酸的部分性质如下表:
物质 | 性质 |
|
|
实验Ⅰ:根据图提供的仪器和试剂,设计实验证明草酸的受热分解产物中含有![]() 和
和![]() 部分夹持仪器和加热装置省略
部分夹持仪器和加热装置省略![]()
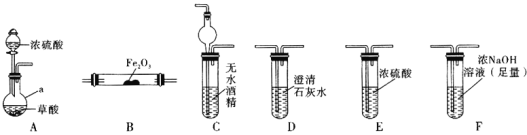
(1)仪器a的名称是_____________。
(2)各装置的正确连接顺序为![]() 装置可重复使用
装置可重复使用![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() 尾气处理。________________
尾气处理。________________
(3)用图中装置C的作用是____________________________。
(4)连接好装置进行的实验时,要先加热________![]() 填“A”“B”“C”“D”“E”或“F”
填“A”“B”“C”“D”“E”或“F”![]() 装置,能证明分解产物中有CO的实验依据是___________________。
装置,能证明分解产物中有CO的实验依据是___________________。
(5)某同学查阅资料发现,用氯化钯![]() 磷钼酸溶液可检验一氧化碳。一氧化碳与氯化钯溶液反应,生成了黑色的金属钯
磷钼酸溶液可检验一氧化碳。一氧化碳与氯化钯溶液反应,生成了黑色的金属钯![]() 固体,反应的化学方程式是___________________________。
固体,反应的化学方程式是___________________________。
实验 Ⅱ:草酸与甲醇在浓硫酸存在下酯化生成草酸二甲酯。反应为![]()
![]()
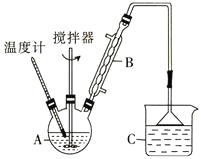
![]() 。在装有搅拌器、分水器的反应瓶中,加入草酸
。在装有搅拌器、分水器的反应瓶中,加入草酸![]() ,无水甲醇
,无水甲醇![]() ,苯
,苯![]() ,浓硫酸
,浓硫酸![]() ,搅拌下加热回流共沸脱水20小时,后转移到烧杯中冷却,按如图所示流程提纯。
,搅拌下加热回流共沸脱水20小时,后转移到烧杯中冷却,按如图所示流程提纯。
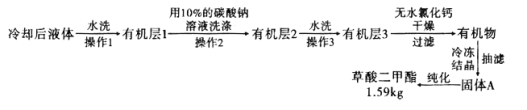
(6)![]() 提纯过程中用
提纯过程中用![]() 的碳酸钠溶液洗涤的作用是__________________________。
的碳酸钠溶液洗涤的作用是__________________________。
![]() 流程中纯化的方法为________________。
流程中纯化的方法为________________。
![]() 产率为____________
产率为____________![]() 精确到
精确到![]() 。
。
【答案】圆底烧瓶 ![]() 除去
除去![]() 中的草酸
中的草酸 ![]() 装置B中红色氧化铁变黑,装置D的澄清石灰水变浑浊
装置B中红色氧化铁变黑,装置D的澄清石灰水变浑浊 ![]() 除去硫酸
除去硫酸![]() 或硫酸、草酸和甲醇
或硫酸、草酸和甲醇![]() 重结晶
重结晶 ![]()
【解析】
![]() 根据装置图回答仪器a名称。
根据装置图回答仪器a名称。
![]() 为证明草酸的受热分解产物中含有
为证明草酸的受热分解产物中含有![]() 和CO,先将混合气体通入无水酒精除去升华出来的草酸,再通入澄清的石灰水检验二氧化碳,如果澄清的石灰水变浑浊,则证明含有二氧化碳气体,再用氢氧化钠溶液吸收二氧化碳,再将洗涤后的气体进行干燥,然后将气体再通过盛有红色氧化铁的装置,一氧化碳和红色的氧化铁反应生成铁和二氧化碳,再用澄清的石灰水检验二氧化碳是否存在,如果澄清石灰水变浑浊,则证明该混合气体中含有一氧化碳。
和CO,先将混合气体通入无水酒精除去升华出来的草酸,再通入澄清的石灰水检验二氧化碳,如果澄清的石灰水变浑浊,则证明含有二氧化碳气体,再用氢氧化钠溶液吸收二氧化碳,再将洗涤后的气体进行干燥,然后将气体再通过盛有红色氧化铁的装置,一氧化碳和红色的氧化铁反应生成铁和二氧化碳,再用澄清的石灰水检验二氧化碳是否存在,如果澄清石灰水变浑浊,则证明该混合气体中含有一氧化碳。
![]() 根据表格知,草酸
根据表格知,草酸![]() 时开始升华,草酸和氢氧化钙反应生成的草酸钙不溶于水,所以制取的气体中含有草酸蒸气而干扰二氧化碳的检验,要检验二氧化碳首先要除去草酸蒸气。
时开始升华,草酸和氢氧化钙反应生成的草酸钙不溶于水,所以制取的气体中含有草酸蒸气而干扰二氧化碳的检验,要检验二氧化碳首先要除去草酸蒸气。
![]() 一氧化碳和氧气的比例在一定范围内易产生爆炸,为防止产生安全事故发生,应先用生成的气体除去装置中的氧气;一氧化碳具有还原性,能还原红色的氧化铁生成铁单质,且生成二氧化碳。
一氧化碳和氧气的比例在一定范围内易产生爆炸,为防止产生安全事故发生,应先用生成的气体除去装置中的氧气;一氧化碳具有还原性,能还原红色的氧化铁生成铁单质,且生成二氧化碳。
![]() 一氧化碳与氯化钯溶液反应,生成了黑色的金属钯
一氧化碳与氯化钯溶液反应,生成了黑色的金属钯![]() 粉末,一氧化碳被氧化为
粉末,一氧化碳被氧化为![]() ,氯化钯中的氯元素变为HCl;
,氯化钯中的氯元素变为HCl;
![]() 酯化反应后的混合液体中除了草酸二甲酯外,还有草酸、甲醇、硫酸与水,先水洗除去大部分的硫酸、草酸和甲醇,有机层再用
酯化反应后的混合液体中除了草酸二甲酯外,还有草酸、甲醇、硫酸与水,先水洗除去大部分的硫酸、草酸和甲醇,有机层再用![]() 的碳酸钠溶液洗涤再除去全部的硫酸、草酸和甲醇,再次用水洗除去残留的碳酸钠,其中每一步的操作都是分液。纯化方法为重结晶。根据题意可知反应中甲醇过量,应用草酸计算产率。
的碳酸钠溶液洗涤再除去全部的硫酸、草酸和甲醇,再次用水洗除去残留的碳酸钠,其中每一步的操作都是分液。纯化方法为重结晶。根据题意可知反应中甲醇过量,应用草酸计算产率。
![]() 根据仪器a结构可得a为圆底烧瓶。
根据仪器a结构可得a为圆底烧瓶。
![]() 为证明草酸的受热分解产物中含有
为证明草酸的受热分解产物中含有![]() 和CO,先将混合气体通入无水酒精除去升华出来的草酸,再通入澄清的石灰水检验二氧化碳,如果澄清的石灰水变浑浊,则证明含有二氧化碳气体,再用氢氧化钠溶液吸收二氧化碳,再将洗涤后的气体进行干燥,然后将气体再通过盛有红色氧化铁的装置,一氧化碳和红色的氧化铁反应生成铁和二氧化碳,再用澄清的石灰水检验二氧化碳是否存在,如果澄清石灰水变浑浊,则证明该混合气体中含有一氧化碳,所以其排序是
和CO,先将混合气体通入无水酒精除去升华出来的草酸,再通入澄清的石灰水检验二氧化碳,如果澄清的石灰水变浑浊,则证明含有二氧化碳气体,再用氢氧化钠溶液吸收二氧化碳,再将洗涤后的气体进行干燥,然后将气体再通过盛有红色氧化铁的装置,一氧化碳和红色的氧化铁反应生成铁和二氧化碳,再用澄清的石灰水检验二氧化碳是否存在,如果澄清石灰水变浑浊,则证明该混合气体中含有一氧化碳,所以其排序是![]() 尾气处理。
尾气处理。
![]() 根据表格知,草酸
根据表格知,草酸![]() 时开始升华,草酸和氢氧化钙反应生成的草酸钙不溶于水,二氧化碳和氢氧化钙反应也生成碳酸钙沉淀,所以制取的气体中含有草酸蒸气而干扰二氧化碳的检验,要检验二氧化碳首先要除去草酸蒸气,所以C的作用是除去
时开始升华,草酸和氢氧化钙反应生成的草酸钙不溶于水,二氧化碳和氢氧化钙反应也生成碳酸钙沉淀,所以制取的气体中含有草酸蒸气而干扰二氧化碳的检验,要检验二氧化碳首先要除去草酸蒸气,所以C的作用是除去![]() 中的草酸。
中的草酸。
![]() 一氧化碳和氧气反应在一定范围内易产生爆炸,为防止产生安全事故发生,应先用生成的气体除去装置中的氧气,所以应先加热A后加热B;一氧化碳具有还原性,能还原红色的氧化铁生成铁单质和二氧化碳,二氧化碳能使澄清石灰水变浑浊,所以反应现象是装置B中红色氧化铁变黑,装置D的澄清石灰水变浑浊。
一氧化碳和氧气反应在一定范围内易产生爆炸,为防止产生安全事故发生,应先用生成的气体除去装置中的氧气,所以应先加热A后加热B;一氧化碳具有还原性,能还原红色的氧化铁生成铁单质和二氧化碳,二氧化碳能使澄清石灰水变浑浊,所以反应现象是装置B中红色氧化铁变黑,装置D的澄清石灰水变浑浊。
![]() 一氧化碳与氯化钯溶液反应,生成了黑色的金属钯
一氧化碳与氯化钯溶液反应,生成了黑色的金属钯![]() 粉末,一氧化碳被氧化为
粉末,一氧化碳被氧化为![]() ,氯化钯中的氯元素变为HCl,反应的化学方程式是
,氯化钯中的氯元素变为HCl,反应的化学方程式是![]() 。
。
![]() 酯化反应后的混合液体中除了草酸二甲酯外,还有草酸、甲醇、硫酸与水,先水洗除去大部分的硫酸、草酸和甲醇,有机层再用
酯化反应后的混合液体中除了草酸二甲酯外,还有草酸、甲醇、硫酸与水,先水洗除去大部分的硫酸、草酸和甲醇,有机层再用![]() 的碳酸钠溶液洗涤再除去全部的硫酸、草酸和甲醇,再次用水洗除去残留的碳酸钠,其中每一步的操作都是分液。
的碳酸钠溶液洗涤再除去全部的硫酸、草酸和甲醇,再次用水洗除去残留的碳酸钠,其中每一步的操作都是分液。
![]() 纯化方法为重结晶。
纯化方法为重结晶。
![]() 根据题意可知反应中甲醇过量,应用草酸计算,根据方程式可知,
根据题意可知反应中甲醇过量,应用草酸计算,根据方程式可知,![]() 的草酸理论上应生成
的草酸理论上应生成![]() 草酸二甲酯,草酸二甲酯的质量为
草酸二甲酯,草酸二甲酯的质量为![]() g,产率
g,产率![]() 。
。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】氨是最重要的化工产品之一,其生产方法也在逐渐改进中,各国科学家均在为提高氨的产量,降低能耗作各种有益的探究;氨在工业上有广泛用途。
(1)合成氨用的H2可以CH4为原料制得。已知相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ·mol-1) | 436 | 351 | 1076 | 463 | 413 |
则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式__________。
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是___。
(3)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得(CH3)2NH。(CH3)2NH显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由小到大的顺序为___。
(4)直接供氨式碱性燃料电池的电池反应式4NH3+3O2=2N2+6H2O,负极电极反应式为___。
(5)如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g)+NO2(g)+2NH3(g)![]() 2N2(g)+3H2O(g)。(注:脱氮率即氮氧化物转化率)
2N2(g)+3H2O(g)。(注:脱氮率即氮氧化物转化率)
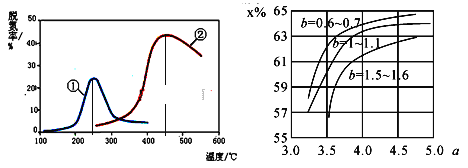
①对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则上述反应的表达式KP=_______。
②以下说法正确的是_________。
A.上述反应的正反应为吸热反应
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
D.曲线①、②最高点表示此时平衡转化率最高
(6)氨气制取尿素的合成塔中发生反应:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。图中为合成塔中不同氨碳比a和水碳比b时二氧化碳转化率(x%),a宜控制在4.0左右,理由是__________。
CO(NH2)2(l)+H2O(g)。图中为合成塔中不同氨碳比a和水碳比b时二氧化碳转化率(x%),a宜控制在4.0左右,理由是__________。
【题目】蛇纹石矿可以看作由MgO、![]() 、
、![]() 和
和![]() 组成。某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si。
组成。某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si。
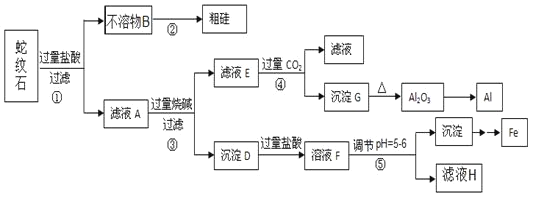
有关氢氧化物沉淀的pH见下表:
金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| 1.9 | 3.2 |
| 9.4 | 11.6 |
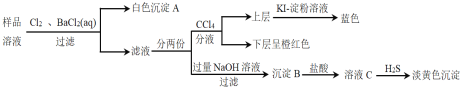
(1)蛇纹石中所含的氧、镁、硫、铝这几种元素的简单离子的半径由小到大的顺序_____,滤液A中含有的阳离子有 _________。
(2)硅元素在周期表中的位置______,二氧化碳的电子式___________。
(3)操作②中反应的化学方程式为 ____,操作④中生成沉淀G的离子方程式为 _____。
(4)操作⑤中调节pH到![]() 时,可以用到的试剂
时,可以用到的试剂![]() 填序号
填序号![]() ____________。
____________。
a、NaOH b、氨水 c、MgO d、Mg(OH)2
(5)从滤液H制取金属Mg的流程如下:
![]()
流程中冶炼镁的方法是__________,在干燥的HCl气流中加热MgCl2·6H2O制取无水氯化镁的原因是__________。