题目内容
NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_________________________________________________________。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
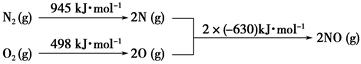
①写出该反应的热化学方程式:_______________________________________。
②随温度升高,该反应化学平衡常数的变化趋势是____。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:____________________________________。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是_____________________________________________,
元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
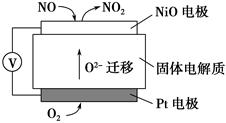
①Pt电极上发生的是________反应(填“氧化”或“还原”)
②写出NiO电极的电极反应式:_______________________________________。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_________________________________________________________。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

①写出该反应的热化学方程式:_______________________________________。
②随温度升高,该反应化学平衡常数的变化趋势是____。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:____________________________________。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是_____________________________________________,
元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

①Pt电极上发生的是________反应(填“氧化”或“还原”)
②写出NiO电极的电极反应式:_______________________________________。
(1)3NO2+H2O=2HNO3+NO
(2)①N2(g)+O2(g)=2NO(g) ΔH=+183 kJ·mol-1 ②增大
(3)①2CO+2NO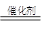 N2+2CO2
N2+2CO2
②根据Mg、Ca、Sr和Ba的质子数,得知它们均为ⅡA族元素。同一主族的元素,从上到下,原子半径逐渐增大
(4)①还原 ②NO+O2--2e-=NO2
(2)①N2(g)+O2(g)=2NO(g) ΔH=+183 kJ·mol-1 ②增大
(3)①2CO+2NO
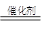 N2+2CO2
N2+2CO2②根据Mg、Ca、Sr和Ba的质子数,得知它们均为ⅡA族元素。同一主族的元素,从上到下,原子半径逐渐增大
(4)①还原 ②NO+O2--2e-=NO2
(1)NO2转化为HNO3的化学方程式为:3NO2+H2O=2HNO3+NO。
(2)①拆开化学键吸收能量,形成化学键释放能量
N2(g)+O2(g)=2NO(g)其ΔH计算方法如下
ΔH=945 kJ·mol-1+498 kJ·mol-1-2×630 kJ·mol-1=+183 kJ·mol-1
②该反应为吸热反应,升高温度,化学平衡向正反应方向移动,化学平衡常数增大。
(3)①NO和CO发生反应生成N2和CO2,其化学方程式为2CO+2NO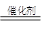 N2+2CO2。
N2+2CO2。
②分析12MgO<20CaO<38SrO<56BaO的排列顺序,不难发现上述四种氧化物对应金属元素为ⅡA族元素,且质子数依次增大,电子层数依次增多,原子半径依次增大,元素的金属性逐渐增强,结合元素周期表的知识,作出合理的解释。
(4)由图示可知发生原电池反应为2NO+O2=2NO2,NO为还原剂,O2为氧化剂,O2在Pt电极电子发生还原反应:O2+4e-=2O2-。NO在NiO电极上失电子发生氧化反应:NO+O2--2e-=NO2。
(2)①拆开化学键吸收能量,形成化学键释放能量
N2(g)+O2(g)=2NO(g)其ΔH计算方法如下
ΔH=945 kJ·mol-1+498 kJ·mol-1-2×630 kJ·mol-1=+183 kJ·mol-1
②该反应为吸热反应,升高温度,化学平衡向正反应方向移动,化学平衡常数增大。
(3)①NO和CO发生反应生成N2和CO2,其化学方程式为2CO+2NO
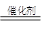 N2+2CO2。
N2+2CO2。②分析12MgO<20CaO<38SrO<56BaO的排列顺序,不难发现上述四种氧化物对应金属元素为ⅡA族元素,且质子数依次增大,电子层数依次增多,原子半径依次增大,元素的金属性逐渐增强,结合元素周期表的知识,作出合理的解释。
(4)由图示可知发生原电池反应为2NO+O2=2NO2,NO为还原剂,O2为氧化剂,O2在Pt电极电子发生还原反应:O2+4e-=2O2-。NO在NiO电极上失电子发生氧化反应:NO+O2--2e-=NO2。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
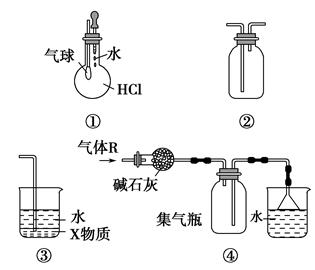
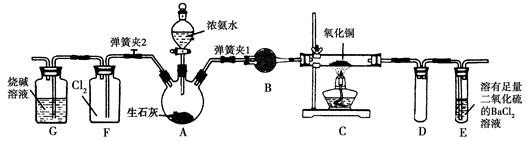

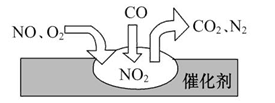
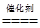 4CO2+N2
4CO2+N2