题目内容
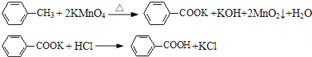
【题目】甲苯氧化法制备苯甲酸的反应原理如下:
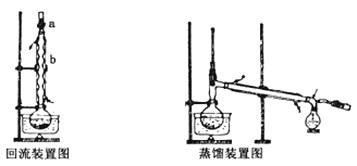
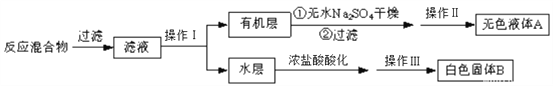
实验时将一定量的甲苯和KMnO4溶液置于图装置中,在100 ℃时,反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。
(1)反应图示装置中,冷凝管的作用是________。
(2)实验室中实现操作I所需的玻璃仪器有_________,烧杯;操作II的名称为_______。
(3)如果操作I后的水层呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,否则会出现的危害是______。
(4)分离出的苯甲酸中若混有少量氯化钾,进一步提纯应采用的操作方法是_______(填名称)。
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为_____。
【答案】 冷凝回流,提高原料利用率 分液漏斗 蒸馏 过量的高锰酸钾氧化盐酸,产生氯气 重结晶 96%
【解析】(1)冷凝管的作用是冷凝回流,提高原料利用率;(2)操作I为分液操作,其所需的玻璃仪器有分液漏斗、烧杯;操作II为蒸馏操作得无色液体A;(3)为了避免过量的高锰酸钾氧化盐酸,产生有毒的氯气,应该先加亚硫酸氢钾除去过量的高锰酸钾,然后再加入浓盐酸酸化;(4)分离出的苯甲酸中若混有少量氯化钾,利用两者的溶解度差,进一步提纯应采用的操作方法是重结晶;(5) c(KOH)=![]() =0.0096 mol·L-1;1L溶液中含KOH的物质的量为0.0096 mol·L-1×1 L=0.0096 mol,在0.56 g苛性钾样品中含KOH的质量为:0.0096 mol×56 g·mol-1=0.5376g,苛性钾的纯度=
=0.0096 mol·L-1;1L溶液中含KOH的物质的量为0.0096 mol·L-1×1 L=0.0096 mol,在0.56 g苛性钾样品中含KOH的质量为:0.0096 mol×56 g·mol-1=0.5376g,苛性钾的纯度=![]() ×100%=96%。
×100%=96%。

练习册系列答案
相关题目