题目内容
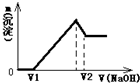 将0.1mol镁、铝合金溶于100mL2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,生成沉淀与所加NaOH溶液体积的关系如图所示.试回答下列问题:
将0.1mol镁、铝合金溶于100mL2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,生成沉淀与所加NaOH溶液体积的关系如图所示.试回答下列问题:(1)当溶液中Mg2+、Al3+恰好沉淀完全时,V(NaOH)=
400
400
mL;(2)当V1=160mL时,金属粉末中镁的物质的量为多少?此时V2的值又是多少?
分析:先分段分析图象,分析每一段图象发生的化学反应有哪些、拐点溶液中溶质的成分是什么,然后结合方程式、原子守恒求出各个物理量.
解答:解:将镁、铝合金溶于H2SO4溶液中,发生反应:Mg+H2SO4=MgSO4+H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑.0.1mol镁、铝合金,完全反应需要硫酸范围:0.1mol<n(H2SO4)<0.15mol,H2SO4有剩余(观察图象更容易得出),溶液是MgSO4、
Al2(SO4)3和H2SO4混合液.
①0--V1阶段,滴加的NaOH用于中和剩余的H2SO4,发生反应是:H2SO4+2NaOH=Na2SO4+2H2O
②V1ml时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液.
③V1--沉淀量最大阶段,继续滴加的NaOH与MgSO4、Al2(SO4)3反应,产生沉淀,发生反应:
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4;MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
④沉淀量最大时时,MgSO4、Al2(SO4)3完全反应,沉淀达到最大值,此时,溶液是Na2SO4溶液.
⑤沉淀量最大--V2ml阶段,继续滴加的NaOH与Al(OH)3反应,沉淀量开始减少,发生反应:Al(OH)3+NaOH=NaAlO2+2H2O
⑥V2ml时,Al(OH)3完全反应,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.
(1)当溶液中Mg2+、Al3+恰好沉淀完全时,即沉淀达到最大值,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2n(H2SO4)=2×0.1L×2mol/L=0.4mol,所以,此时,V(NaOH)=
=0.4L=400ml
故答案为:400;
(2)当V1=160mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=
n(Na+)=
n(NaOH)=
×0.16L×1mol/L=0.08mol
令MgSO4为xmol,Al2(SO4)3为ymol,根据Mg原子、Al原子、SO42-离子守恒有:
;解得:
所以金属粉末中n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol
此时V2时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.1L×2mol/L×+0.04mol=0.44mol,
所以,V2=
=0.44L=440ml
答:镁的物质的量为0.06mol,V2的值是440 mL.
Al2(SO4)3和H2SO4混合液.
①0--V1阶段,滴加的NaOH用于中和剩余的H2SO4,发生反应是:H2SO4+2NaOH=Na2SO4+2H2O
②V1ml时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液.
③V1--沉淀量最大阶段,继续滴加的NaOH与MgSO4、Al2(SO4)3反应,产生沉淀,发生反应:
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4;MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
④沉淀量最大时时,MgSO4、Al2(SO4)3完全反应,沉淀达到最大值,此时,溶液是Na2SO4溶液.
⑤沉淀量最大--V2ml阶段,继续滴加的NaOH与Al(OH)3反应,沉淀量开始减少,发生反应:Al(OH)3+NaOH=NaAlO2+2H2O
⑥V2ml时,Al(OH)3完全反应,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.
(1)当溶液中Mg2+、Al3+恰好沉淀完全时,即沉淀达到最大值,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2n(H2SO4)=2×0.1L×2mol/L=0.4mol,所以,此时,V(NaOH)=
| 0.4mol |
| 1mol/L |
故答案为:400;
(2)当V1=160mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
令MgSO4为xmol,Al2(SO4)3为ymol,根据Mg原子、Al原子、SO42-离子守恒有:
|
|
所以金属粉末中n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol
此时V2时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.1L×2mol/L×+0.04mol=0.44mol,
所以,V2=
| 0.44mol |
| 1mol.L |
答:镁的物质的量为0.06mol,V2的值是440 mL.
点评:对于图象分析题的解题规律:要明确每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
 Ⅰ.(1)利用水煤气合成二甲醚(CH3OCH3)的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-274KJ/mol.该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是
Ⅰ.(1)利用水煤气合成二甲醚(CH3OCH3)的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-274KJ/mol.该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是