题目内容
 Ⅰ.(1)利用水煤气合成二甲醚(CH3OCH3)的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-274KJ/mol.该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是
Ⅰ.(1)利用水煤气合成二甲醚(CH3OCH3)的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-274KJ/mol.该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是A.加入催化剂 B.缩小容器的体积
C.升高温度计 D.分离出二甲醚
E.增加CO的浓度
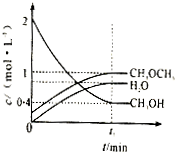
(2)二甲醚也可以通过CH3OH分子间脱水制得2CH3OH(g)?CH3OCH3(g)+H2O(g).在
T℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.在相同条件下,若改变起始浓度,某时刻各组分浓度依次为:c(CH3OCH3)=0.6mol/L、c(CH3OH)=0.3mol/L、c(H2O)=0.45mol/L,此时正、逆反应速率的大小:v(正)
Ⅱ.(1)将一定量镁粉投入饱和氯化铵溶液中会产生气泡,请用简洁的文字和反应方程式解释
(2)相同温度下,将足量硫酸钡固体分别放入相同体积的①0.1mol/L硫酸铝溶液,②0.1mol/L氯化钡溶液,③蒸馏水,④0.1mol/L硫酸溶液中,Ba2+浓度由大到小的顺序是:
(3)常温下,已知某酸HA的电离平衡常数Ka为4×10-5mol/L,则浓度为0.4mol/L的HA酸溶液中HA电离达到平衡时溶液的PH为
(2)先计算平衡常数,在计算此时的浓度商Qc,与平衡常数比较判断反应进行方向,据此解答;
Ⅱ(1)铵根离子水解,溶液呈酸性,Mg与氢离子反应生成氢气,反应放热,氢离子浓度降低,促进水解平衡,有氨气逸出;
(2)含有相同离子的溶液能抑制硫酸钡的溶解,结合离子浓度与硫酸钡溶度积为常数判断;
(3)令HA电离产生的氢离子浓度为xmol/L,依据电离平衡计算c(H+),再根据pH=-lgc(H+)计算.
B.缩小容器的体积,压强增大,反应速率加快,平衡向正反应方向移动,二甲醚的产率增大,故B正确;
C.升高温度,反应速率加快,平衡向逆反应方向移动,二甲醚的产率降低,故C错误;
D.分离出二甲醚,平衡向正反应方向移动,二甲醚的产率增大,但反应速率降低,故D错误;
E.增加CO的浓度,反应速率加快,平衡向正反应方向移动,二甲醚的产率增大,故E正确;
故答案为;BE,
(2)由图可知,平衡时CH3OH(g)的浓度为0.4mol/L,CH3OCH3(g)的浓度为1mol/L,H2O(g)的浓度为
| 1 |
| 2 |
| 1×0.8 |
| 0.42 |
| 0.6×0.45 |
| 0.33 |
故答案为:大于;
Ⅱ(1)在氯化铵溶液中存在平衡:NH4++H2O?NH3?H2O+H+,加入镁粉后,发生反应Mg+2H+=Mg2++H2↑,反应放热,且c(H+)降低,使水解平衡右移,c(NH3?H2O)增大,NH3?H2O分解生成氨气,
故答案为:在氯化铵溶液中存在平衡:NH4++H2O?NH3?H2O+H+,加入镁粉后,发生反应Mg+2H+=Mg2++H2↑,反应放热,且c(H+)降低,使水解平衡右移,c(NH3?H2O)增大,NH3?H2O分解生成氨气;
(2)根据难溶电解质的溶度积常数知,溶液中硫酸根离子浓度越大,硫酸钡的溶解度越小,钡离子浓度越低,氯化钡能抑制硫酸钡的电离,但氯化钡溶液中含有钡离子,所以钡离子浓度最大,水中的钡离子浓度次之,硫酸铝溶液和硫酸溶液中都含有硫酸根离子,抑制硫酸钡的电离,硫酸铝中的硫酸根浓度大于硫酸中的浓度,所以硫酸铝溶液中钡离子的浓度小于硫酸溶液中钡离子浓度,所以钡离子浓度大小顺序是②>③>④>①,
故答案为:②>③>④>①;
(3)令HA电离产生的氢离子浓度为xmol/L,则:
HA?H++A-,
x x x
故溶液中c(HA)=(0.4-x)mol/L,c(A-)=xmol/L,c(H+)=xmol/L+c水(H+)≈xmol/L,故
| x×x |
| 0.4-x |
| x×x |
| 0.4 |
故答案为:2.4.

二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚(CH3OCH3)。
请回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:(甲醇:CH3OH)
① 2H2(g)+ CO(g) CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g) CO2(g)+ H2(g);ΔH= -41.3 kJ·mol-1
则利用水煤气合成二甲醚的总反应的热化学方程式为______________________.
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(2)、 已知反应②2CH3OH(g) CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆(填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
(14分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
(1)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)
+ CO(g)  CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g)
+ H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g)
+ H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g)
 CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) +
3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH= ___________;
CH3OCH3(g) + CO2 (g)的ΔH= ___________;
(2) 已知反应②2CH3OH(g)  CH3OCH3(g)
+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)
+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
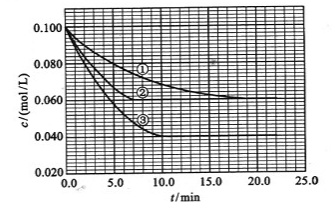
(3)在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为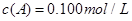 、
、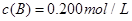 及
及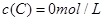 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_______________;______________________________________________;
③_______________________________________________;
该反应的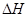 _________0,判断其理由是__________________________________;
_________0,判断其理由是__________________________________;
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚(CH3OCH3)。
请回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:(甲醇:CH3OH)
① 2H2(g)
+ CO(g)  CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g)
 CO2(g)
+ H2(g);ΔH= -41.3 kJ·mol-1
CO2(g)
+ H2(g);ΔH= -41.3 kJ·mol-1
则利用水煤气合成二甲醚的总反应的热化学方程式为______________________.
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(2)、 已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.