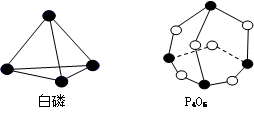
题目内容
化学反应H2+Cl2===2HCl的能量变化如图所示,则下列说法正确的是
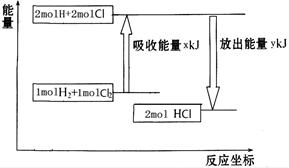

| A.该反应是放热反应 |
| B.断裂1 mol H—H键和1 mol Cl—Cl 键放出x kJ能量 |
| C.断裂1 mol H—Cl键需要吸收y kJ的能量 |
| D.2 mol HCl的总能量高于1 mol H2和1 molCl2的总能量 |
A
试题分析:根据图像可知,反应物的总能量高于生成物的总能量,所以反应是放热反应,A正确,D不正确;断键是吸热的,B不正确;根据图像可知,断裂1 mol H—Cl键需要吸收y/2kJ的能量,C不正确,答案选A。
点评:该题是基础性试题的考查,主要是考查学生对反应热含义以及反应热计算的熟悉了解程度,旨在巩固学生的基础,提高学生的应试能力。明确反应热与反应物和生成物总能量的相对大小以及化学键变化时热量的变化是答题的关键,有利于培养学生的逻辑推理能力。

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
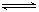 3O2 ;O3
3O2 ;O3
 ·8H
·8H Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。则下列说法正确的是
Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。则下列说法正确的是 2HI(g) ΔH =-9.48 kJ·mol-1
2HI(g) ΔH =-9.48 kJ·mol-1