题目内容
工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ/mol,下列判断正确的是( )
| A.反应物能量总和小于生成物能量总和 |
| B.CO(g)+H2(g)=C(s)+H2O(g) ΔH=+131.4 kJ/mol |
| C.水煤气反应中,生成1 mol H2(g)吸收131.4 kJ热量 |
| D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |
AC
试题分析:A.该反应是吸热反应说明生成物的总能量大于反应物的总能量。正确。B.CO(g)+H2(g)=C(s)+H2O(g) ΔH=-131.4 kJ/mol。错误。C.根据反应的热化学方程式可知:在水煤气反应中,每生成1 mol H2(g)和CO(g)就会吸收131.4 kJ热量。正确。D.在热化学方程式中,计量数只表示该物质的物质的量。错误。

练习册系列答案
相关题目
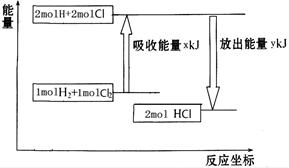
 2NH3(g)ΔH="-92.4" kJ/mol,该反应的能量变化如图所示。
2NH3(g)ΔH="-92.4" kJ/mol,该反应的能量变化如图所示。
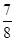 ,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。

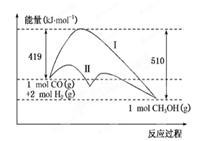
 CH3OH(g)过程中的能量变化情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是
CH3OH(g)过程中的能量变化情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是