题目内容
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为
| A.10mol | B.11mol | C.12mol | D.13mol |
B
解析试题分析:这是一个氧化还原反应,氧化剂所得到的电子数与还原剂所失去的电子数相等,每反应掉2mol的碘酸铜就反应掉24mol的碘化钾,其中作还原剂的碘化钾为22mol,共失去22mol的电子,那么有1mol的氧化剂参加反应时,所得到的电子就为11mol。选B
考点:考查氧化还原反应。

练习册系列答案
相关题目
将69 g NO2(含少量N2O4)通入水中,关于此过程下列说法正确的是(NA表示阿伏加德罗常数)
| A.69 g NO2与N2O4混合气体所含原子数介于4.5 NA至9.0 NA之间 |
| B.此反应中转移的电子数为NA |
| C.最终可收集到11.2 L无色气体 |
| D.若将所得硝酸制成浓硝酸,常温下最多可溶解0.25 mol铁。 |
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是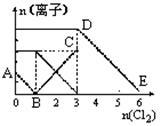
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中n(FeBr2)=3mol |
| C.当通入Cl22mol时,溶液中已发生的离子反应可表示为: 2Fe2++2I-+2C12=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+):n(I-):n(Br-)=3:1: 2 |
下列类型的反应中,一定不属于氧化还原反应的是( )。
| A.化合反应 | B.置换反应 | C.分解反应 | D.复分解反应 |
据报道,科学家发现了如下反应:O2+PtF6→O2(PtF6)。已知O2(PtF6)为离子化合物,其中Pt为+5价。对于此反应,下列说法正确的是( )
| A.此反应是非氧化还原反应 |
| B.O2(PtF6) 中氧元素的化合价是+1价 |
| C.在此反应中,O2是氧化剂,PtF6是还原剂 |
| D.此反应中,每生成1mol O2(PtF6)转移1mol 电子 |
对于以下的反应过程,一定要加入氧化剂才能够实现的是( )
| A.O2→H2O | B.SO2→SO42— | C.H2SO4→CuSO4 | D.HNO3→NO2 |
反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是
| A.两个反应中均为硫元素被氧化 |
| B.碘元素在反应①中被还原,在反应②中被氧化 |
| C.氧化性:MnO2>SO42->IO3->I2 |
| D.反应①、②中生成等量的I2时转移电子数比为1:5 |
锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。生成1 mol硝酸锌时,被还原的硝酸的物质的量为( )
| A.2 mol | B.1 mol | C.0.5 mol | D.0.25 mol |
下列氧化还原反应中,水作为氧化剂的是( )
A.CO + H2O CO2 + H2 CO2 + H2 |
| B.3NO2+ H2O = 2HNO3 + NO |
| C.2Na2O2 + 2H2O =" 4NaOH" + O2↑ |
| D.2F2 + 2H2O =" 4HF" + O2 |