题目内容
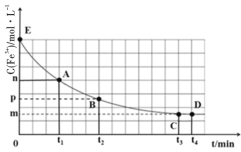
【题目】25℃时,向40mL0.05mol/L的FeCl3溶液中一次性加入10mL0.15mol/L的KSCN溶液,发生反应,混合溶液中c(Fe3+)与反应时间(t)的变化如图所示。下列说法正确的是( )
A.该反应的离子方程式为Fe3++3SCN-![]() Fe(SCN)3↓
Fe(SCN)3↓
B.E点对应的坐标为(0,0.05)
C.t4时向溶液中加入50mL0.1mol/LKCl溶液,平衡不移动
D.若该反应是可逆反应,在25℃时平衡常数的数值为![]()
【答案】D
【解析】
A.Fe3+与SCN-反应生成络合物,不是沉淀,离子方程式为Fe3++3SCN-![]() Fe(SCN)3,故A错误;
Fe(SCN)3,故A错误;
B.E点为反应起点,混合溶液体积为50mL,此时溶液中c(Fe3+)=![]() =0.04mol/L,所以E点对应的坐标为(0,0.04),故B错误;
=0.04mol/L,所以E点对应的坐标为(0,0.04),故B错误;
C.t4时向溶液中加入50mL0.1mol/LKCl溶液,相当于稀释溶液,平衡逆向移动,故C错误;
D.由图可知,平衡时Fe3+浓度为m,则Fe(SCN)3浓度为0.04-m,SCN-的浓度为![]() -3×(0.04-m)=3m-0.09,所以平衡常数K=
-3×(0.04-m)=3m-0.09,所以平衡常数K=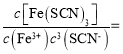
![]() ,故D正确;
,故D正确;
故答案为D。

练习册系列答案
相关题目