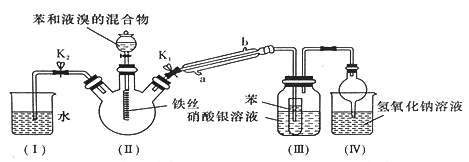
题目内容
【题目】实验室需要0.3 mol·L-1 NaOH溶液480 mL和一定浓度的硫酸溶液。根据这两种溶液的配制情况回答下列问题:
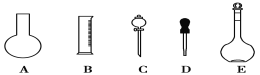
(1)如图所示的仪器中配制溶液肯定不需要的是___(填序号),配制上述溶液还需用到的玻璃仪器是___(填仪器名称)。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________(填“>”、“<”或“=”)0.3 mol·L-1。
(3)实验室采购了98%(ρ=1.84gcm﹣3)的硫酸配制3.68molL﹣1的硫酸溶液500mL需准确量取98%的硫酸_____mL;
(4)该同学实际配制硫酸溶液的浓度为3.50 mol·L-1,原因可能是___________(填序号)。
A.用胶头滴管加水时俯视刻度 B.容量瓶中原来存有少量水
C.稀释硫酸的烧杯,溶液转移后未洗涤 D.用胶头滴管加水定容时仰视刻度
(5)若在滴加蒸馏水时,不慎超过了刻度线,此时应如何处理?______________。
【答案】AC烧杯、玻璃棒6.0<100mLCD重新配制
【解析】
(1)配制溶液需要五种玻璃仪器:量筒、烧杯、玻璃棒、胶头滴管、容量瓶,用不到分液漏斗和烧瓶,故答案为:AC;烧杯、玻璃棒;
(2)①要配制0.3mol/L NaOH溶液480mL,应选择500mL容量瓶,需要氢氧化钠质量=0.3mol/L×0.5L×40g/mol=6.0g,故答案为:6.0;
②若NaOH溶液在转移至容量瓶时,洒落了少许,导致溶质的物质的量偏小,则所得溶液浓度<0.3 mol·L-1,故答案为:<;
(3)98%(ρ=1.84gcm-3)的硫酸的物质的量浓度c= ![]() mol/L =18.4mol/L,设需要浓硫酸体积为V,依据溶液稀释前后所含溶质的物质的量不变,有:V×18.4mol/L=3.68molL-1×500mL,解得V=100.0mL;故答案为:100 mL;
mol/L =18.4mol/L,设需要浓硫酸体积为V,依据溶液稀释前后所含溶质的物质的量不变,有:V×18.4mol/L=3.68molL-1×500mL,解得V=100.0mL;故答案为:100 mL;
(4)A.用胶头滴管加水时俯视刻度,导致配制的溶液的体积偏小,溶液浓度偏高,故A错误;B.容量瓶中原来存有少量水,对溶质的物质的量及溶液的体积都没有影响,所以不影响配制结果,故B错误;C.稀释硫酸的烧杯,溶液转移后未洗涤,导致配制的溶液中溶质硫酸的物质的量偏小,配制的溶液浓度偏低,故C正确;D.用胶头滴管加水定容时仰视刻度,导致配制时加入的蒸馏水体积偏大,配制的溶液浓度偏低,故D正确;故答案为:CD;
(5)在滴加蒸馏水时,不慎超过了刻度线,说明实验失败,应该洗净容量瓶后重新配制,故答案为:重新配制。

【题目】探究Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O 反应的速率影响因素,设计了以下实验,下列说法正确的是
锥形瓶 | 0.1molLNa2S2O3 溶液/mL | 蒸馏水 | 0.2mol/L H2SO4 溶液 | 反应温度 | 浑浊出现时间/s | 备注 |
1 | 10 | 0 | 10 | 20℃ | 10 | |
2 | 10 | 5 | 5 | 20℃ | 16 | |
3 | 10 | 0 | 10 | 50℃ | 5 | 第10 秒开始浑浊不再增多 |
4 | 10 | 6 | 4 | 50℃ | 8 |
A. 该反应也可通过测SO2的体积变化来表示化学反应速率的快慢
B. 3号瓶用Na2S2O3 来表示速率为0.0lmol/(Ls)
C. 由2号瓶和3号瓶实验结果可得温度越高反应速率越快
D. 由1号瓶和4号瓶实验结果可得温度越高反应速率越快
【题目】氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 N2(g)+O2(g) | 工业固氮 N2(g)+3H2(g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于_______(填“吸热”或“放热”)反应。
②分析数据可知:现代工业生产不采用“大气固氮”原理的原因:_______。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因______________。
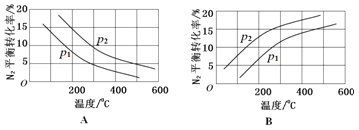
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,下图所示的图示中,正确的是____(填“A”或“B”);比较P1、P2的大小关系_______。
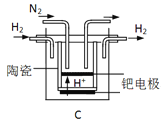
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是__________。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g),则其反应热△H=________。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热△H=________。(已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)
2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)![]() 2H2O(l) △H=-571.6kJ·mol-1)
2H2O(l) △H=-571.6kJ·mol-1)