题目内容
【题目】Sn元素位于元素周期表第IVA族,SnCl4可用作媒染剂和催化剂,工业上常用氯气与金属锡在300℃反应制备SnCl4。SnCl4极易水解,SnCl2、SnCl4的一些物理数据如下:
物质 | 状态 | 熔点/X; | 沸点/X; |
Sn | 银白色固体 | 232 | 2 260 |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
用下列装置合成四氯化锡(夹持装置略)。
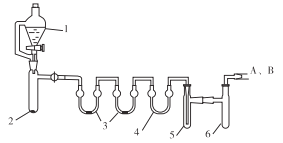
注:仪器3中各加入0.6 mL浓硫酸
实验操作如下:
a.把干燥的仪器按图示装置连接好,在仪器1中加入8 mL浓盐酸,在仪器2中加入1.0 g KClO3,在仪器5中加入2~3颗Sn粒;
b.打开活塞,让盐酸流下,均匀产生Cl2并充满整套装置,然后加热Sn粒,将生成的SnCl4收集在仪器 6中;
c.Sn粒反应完毕后,停止加热,同时停止滴加盐酸,取下仪器6,迅速盖好盖子。
请回答:
(1)仪器1的名称是___________。
(2)下列说法不正确的是______。
A.装置连接好,加入药品前要检査装置的气密性
B.产生的Cl2先充满整套装置,这步操作不可以省略
C.操作中应控制盐酸的滴入速率,不能太快,也不能太慢
D.仪器6可用冰水浴冷却,也可以自然冷却
(3)仪器6后还应连接A、B装置,A装置的作用是_____________。
(4)已知SnCl2易水解,易氧化,且还原性:Sn2+>I-,SnCl4氧化性弱。有关SnCl4和SnCl2的说法不正确的是_________。
A.实验室配制SnCl2溶液时,除加入盐酸外,还应加入锡粒
B.将产品溶于盐酸,可用溴水检测,若溴水橙色褪去,说明SnCl4中含有SnCl2
C. SnCl4在空气中与水蒸气反应生成白色SnO2·xH2O固体,只看到有白烟现象,化学方程式为SnCl4+(x+2)H2O=SnO2·xH2O+4HC1
(5)经测定产品中含冇少量的SnCl2,可能的原因(用化学方程式表示):_______________。
(6)产品中含少量SnCl2,测定SnCl4纯度的方法:取0.200 g产品溶于50 mL的稀盐酸中,加入淀粉溶液 作指示剂,用0.0100mol/L碘酸钾标准溶液滴定至终点,消耗标准液4.00 mL,反应原理为:3 SnCl2+KIO3+6HC1=3SnCl4+KI+3H2O,判断滴定终点的依据为_______,产品的纯度为______。
【答案】 恒压漏斗或滴液漏斗 D 干燥作用 C Sn+2HCl=SnCl2+H2↑(或SnCl4+Sn=2SnCl2) 当滴入最后一滴标准液,溶液出现蓝色且半分钟不褪色 88.6%。
【解析】考查实验方案设计与评价,(1)根据仪器的特点,仪器1为恒压漏斗或滴液漏斗;(2)A、根据实验目的,本实验需要气体参与,因此实验前需要检验装置的气密性,故A说法正确;B、Sn与氧气能够反应,防止Sn被氧气氧化,因此用氯气排除装置中的空气,故B说法正确;C、为了提高原料的利用,需要控制盐酸的滴入速率,故C说法正确;D、冰水浴冷却效果比自然冷却效果好,因此参与冰水浴冷却,故D说法错误;(3)SnCl4极易水解,因此要防止空气中水蒸气进入到装置6中,因此A的作用是防止空气中水蒸气进入装置6;(4)A、加入盐酸的目的是抑制Sn2+的水解,根据信息,Sn2+具有强还原性,因此加入Sn的目的是防止Sn2+被氧化,故A说法正确;B、溴水具有强氧化性,如果含有SnCl2,溴水褪色,如果不含有SnCl2,则溴水不褪色,故B说法正确;C、根据化学反应方程式,现象是出现白色烟雾,故C说法错误;(5)根据金属活动顺序表,Sn排在H的左边,因此Sn与盐酸反应:Sn+2HCl=SnCl2+H2↑,也有可能发生SnCl4+Sn=2SnCl2;(6)根据化学反应方程式,当滴入最后一滴KIO3,KIO3把KI氧化成I2,淀粉变蓝,因此滴定到终点现象是: 当滴入最后一滴标准液,溶液出现蓝色且半分钟不褪色;根据反应方程式,求出样品中m(SnCl4)=(0.2-4×10-3×0.01××3×190)g,产品纯度是(0.2-4×10-3×0.01××3×190)/0.2×100%=88.6%。