题目内容
常温下,下列有关电解质溶液的叙述正确的是
- A.等浓度等体积的强酸与强碱溶液混合后,溶液的pH=7
- B.将10 mL pH=a的盐酸与100 mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13
- C.pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等体积混合后溶液的pH=10.7(已知lg 2=0.3)
- D.pH=2的盐酸与pH=12的氨水等体积混合后所得溶液显中性
B
分析:A.强酸强碱混合溶液的酸碱性不仅取决于酸碱的物质的量还取决于酸和碱的元数;
B.酸碱恰好中和,则盐酸中n(H+)等于氢氧化钡中n(OH-);
C.根据混合溶液中氢氧根离子浓度计算溶液的PH;
D.根据溶液中溶质判断溶液酸碱性.
解答:A.强酸强碱混合溶液的酸碱性不仅取决于酸碱的物质的量还取决于酸和碱的元数,如果n(H+)>n(OH-),溶液呈酸性,如果n(H+)>n(OH-),溶液呈中性,如果n(H+)<n(OH-),溶液呈碱性,故A错误;
B.氯化氢和氢氧化钡都是强电解质,酸碱恰好中和,则盐酸中n(H+)等于氢氧化钡中n(OH-),所以10-a mol/L×0.01L=1014-b mol/L×0.1L,则a+b=13,故B正确;
C.混合溶液中c(OH-)=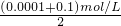 ,c(H+)=
,c(H+)=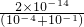 mol/L=2×10-13mol/L,pH=12.7,故C错误;
mol/L=2×10-13mol/L,pH=12.7,故C错误;
D.pH=2的盐酸与pH=12的氨水,氨水的物质的量浓度大于盐酸,所以两种溶液等体积混合后所得溶液显碱性,故D错误;
故选B.
点评:本题考查混合溶液酸碱性的判断及pH的有关计算,根据pH的计算公式及弱电解质电离特点来分析解答,难度中等.
分析:A.强酸强碱混合溶液的酸碱性不仅取决于酸碱的物质的量还取决于酸和碱的元数;
B.酸碱恰好中和,则盐酸中n(H+)等于氢氧化钡中n(OH-);
C.根据混合溶液中氢氧根离子浓度计算溶液的PH;
D.根据溶液中溶质判断溶液酸碱性.
解答:A.强酸强碱混合溶液的酸碱性不仅取决于酸碱的物质的量还取决于酸和碱的元数,如果n(H+)>n(OH-),溶液呈酸性,如果n(H+)>n(OH-),溶液呈中性,如果n(H+)<n(OH-),溶液呈碱性,故A错误;
B.氯化氢和氢氧化钡都是强电解质,酸碱恰好中和,则盐酸中n(H+)等于氢氧化钡中n(OH-),所以10-a mol/L×0.01L=1014-b mol/L×0.1L,则a+b=13,故B正确;
C.混合溶液中c(OH-)=
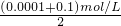 ,c(H+)=
,c(H+)=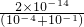 mol/L=2×10-13mol/L,pH=12.7,故C错误;
mol/L=2×10-13mol/L,pH=12.7,故C错误;D.pH=2的盐酸与pH=12的氨水,氨水的物质的量浓度大于盐酸,所以两种溶液等体积混合后所得溶液显碱性,故D错误;
故选B.
点评:本题考查混合溶液酸碱性的判断及pH的有关计算,根据pH的计算公式及弱电解质电离特点来分析解答,难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
(9分)工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
(1)写出电解饱和氯化钠溶液时,总离子反应方程式: _____ __。
(2)下列有关说法正确的是
| A.电解一段时间后,往蛋壳内溶液中滴加几滴紫色石蕊试液,先变红后又褪色 |
| B.蛋壳表面缠绕铁丝发生氧化反应 |
| C.为增强导电性,可将石墨棒换成铜电极 |
| D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触 |
(4)若将电解后阳极所产生的气体全部通入1 mol/L 500 mL Na2SO3的溶液中,使之充分反应(假设溶液的体积变化忽略不计),则所得溶液中SO42-的物质的量浓度最多为________ mol/L。
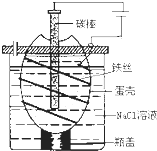 工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
