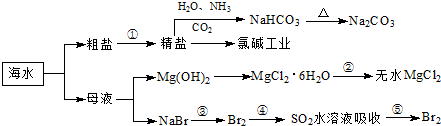
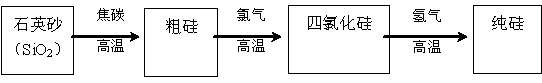
��Ŀ����
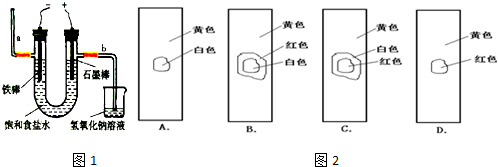
��9�֣���ҵ��ͨ����ⱥ���Ȼ�����Һ�ķ�������������ƺ�������ͼΪijʵ��С�����Ƶĵ�ⱥ��ʳ��ˮ�ļ���װ�ã�
��1��д����ⱥ���Ȼ�����Һʱ�������ӷ�Ӧ����ʽ�� _____ __��
��2�������й�˵����ȷ����
| A�����һ��ʱ�������������Һ�еμӼ�����ɫʯ����Һ���ȱ�������ɫ |
| B�����DZ��������˿����������Ӧ |
| C��Ϊ��ǿ�����ԣ��ɽ�ʯī������ͭ�缫 |
| D�����ǿ���ֹ���ɵ�����������������������Һ�Ӵ� |
��4��������������������������ȫ��ͨ��1 mol/L 500 mL Na2SO3����Һ�У�ʹ֮��ַ�Ӧ��������Һ������仯���Բ��ƣ�����������Һ��SO42-�����ʵ���Ũ�����Ϊ________ mol/L��
��1��2Cl��+2H2O Cl2��+ H2��+ 2OH-����2�֣�
Cl2��+ H2��+ 2OH-����2�֣�
��2��AD ��1�֣� ��3��1.68L �� 2�֣��� 13 �� 1����
Cl2 + 2OH- ="=" Cl�� + ClO�� + H2O ��1�֣� C��Cl���� ��C��ClO�� ����C�� OH-�� ��1�֣�
��4��0.5 mol/L ��1�֣�
����

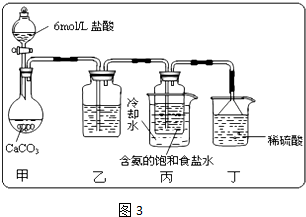
 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д���ҵ���õ�ⱥ��NaCl��Һ�ķ�������ȡNaOH��Cl2��H2����������Ϊԭ������һϵ�л�����Ʒ����Ϊ�ȼҵ��
��1����������Ĥ��������ʳ��ˮʱ��Cl2����NaOH��ֽӴ������²������NaClO��H2����Ĥ��������ʳ��ˮ��Ӧ�����ӷ���ʽΪ ��
��2���ȼҵ���ܸߣ�һ�ֽ�������ȼ�ϵ������ϵ��¹��տ��Խڣ��磩��30�����ϡ������ֹ�������У�������ϵĴ�����ת����ϵ����ͼ��ʾ�����еĵ缫δ��������õ�����Ĥ��ֻ����������ͨ����

�پ����Ƶı���NaCl��ҺӦ��ͼ�е��ص� ����д���� ���ҡ�����ע�롣
��ͼ��X��____ __���ѧʽ�����������ҵĵ缫��ӦʽΪ�� _ ��ͼʾ������������Һ��������a����b���Ĺ�ϵ�� ������ĸ����
A. a%=b% B. a%��b% C. a%��b%
�ۼ��е����ӽ���ĤΪ ��������ӽ���Ĥ���������ӽ���Ĥ������
��3���ȼҵ�IJ���NaOH�벻ͬ���ʷ�Ӧ�������ɲ�ͬ���Ρ���֪�����£�Ũ�Ⱦ�Ϊ0.1 mol/L��4��������ҺpH���±���
|
���� |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
|
pH |
11.6 |
9.7 |
10.3 |
5.2 |
����˵���У�����ȷ���� ������ĸ��
a������ˮ�м���NaHCO3������������ˮ�д������Ũ��
b��������Һ�У�ˮ�ĵ���̶�������NaClO
c�������£���ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��pH������H2SO3
d��NaHSO3��Һ������Ũ�ȴ�С˳��Ϊc��Na+��> c��H+��>c��HSO3-�� >c��SO32-��>c��OH-��